 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2023年广东省普通高中学业水平选择性考 | |
|---|---|
| 本卷共有试题:20 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||||||||
出处 |
2023广东 | |||||||||
| 题干 | “高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是
|
|||||||||
答案 |
C |
|||||||||
| 题号 | 2 |
|
||
出处 |
2023广东 | |||
| 题干 | 科教兴国,“可上九天揽月,可下五洋捉鳖”。下列说法正确的是 A. “天舟六号”为中国空间站送去推进剂Xe气,Xe是第IA族元素 B.火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为FeO C.创造了可控核聚变运行纪录的“人造太阳”,其原料中的2H与3H互为同位素 D. “深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为金属晶体 |
|||
答案 |
C |
|||
| 题号 | 3 |
|
||
出处 |
2023广东 | |||
| 题干 | 建设美丽乡村,守护中华家园,衣食住行皆化学。下列说法正确的是 A.千家万户通光纤,光纤的主要材质为Si B.乡村公路铺沥青,沥青属于天然无机材料 C.美容扮靓迎佳节,化妆品中的甘油难溶于水 D.均衡膳食助健康,主食中的淀粉可水解为葡萄糖 |
|||
答案 |
D | |||
| 题号 | 4 |
|
||
出处 |
2023广东 | |||
| 题干 | 1827年,英国科学家法拉第进行了NH3喷泉实验。在此启发下,兴趣小组利用以下装置,进行如下实验。其中,难以达到预期目的的是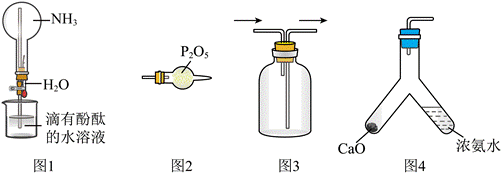 A.图1:喷泉实验 B.图2:干燥NH3 C.图3:收集NH3 D.图4:制备NH3 |
|||
答案 |
B |
|||
| 题号 | 5 |
|
||
出处 |
2023广东 | |||
| 题干 | 化学处处呈现美。下列说法正确的是 A.舞台上干冰升华时,共价键断裂 B.饱和CuSO4溶液可析出无水蓝色晶体 C.苯分子的正六边形结构,单双键交替呈现完美对称 D.晨雾中的光束如梦如幻,是丁达尔效应带来的美景 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2023广东 | |||
| 题干 | 负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是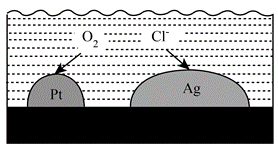 A. Ag作原电池正极 B.电子由Ag经活性炭流向Pt C. Pt表面发生的电极反应:O2+2H2O+4e-=4OH- D.每消耗标准状况下11.2L的O2,最多去除1 mol Cl- |
|||
答案 |
B | |||
| 题号 | 7 |
|
|||||||||||||||
出处 |
2023广东 | ||||||||||||||||
| 题干 | 劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是
|
||||||||||||||||
答案 |
C |
||||||||||||||||
| 题号 | 8 |
|
||
出处 |
2023广东 | |||
| 题干 | 2022年诺贝尔化学奖授予研究“点击化学”的科学家。图所示化合物是“点击化学”研究中的常用分子。关于该化合物,说法不正确的是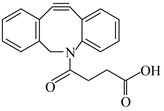 A.能发生加成反应 B.最多能与等物质的量的NaOH反应 C.能使溴水和酸性KMnO4溶液褪色 D.能与氨基酸和蛋白质中的氨基反应 |
|||
答案 |
B | |||
| 题号 | 9 |
|
||
出处 |
2023广东 | |||
| 题干 | 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是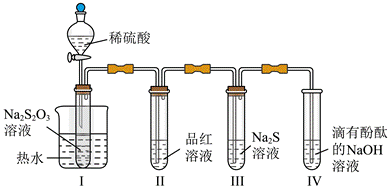 A.Ⅰ中试管内的反应,体现H+的氧化性 B.Ⅱ中品红溶液褪色,体现SO2的还原性 C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D.撤掉水浴,重做实验,Ⅳ中红色更快褪去 |
|||
答案 |
C |
|||
| 题号 | 10 |
|
||
出处 |
2023广东 | |||
| 题干 | 部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是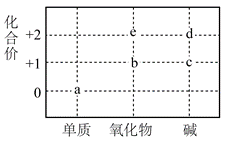 A.可存在c→d→e的转化 B.能与H2O反应生成c的物质只有b C.新制的d可用于检验葡萄糖中的醛基 D.若b能与H2O反应生成O2,则b中含共价键 |
|||
答案 |
B | |||
| 题号 | 11 |
|
||
出处 |
2023广东 | |||
| 题干 | 设NA为阿伏加德罗常数的值。侯氏制碱法涉及NaCl、NH4Cl和NaHCO3等物质。下列叙述正确的是 A. 1molNH4Cl含有的共价键数目为5NA B.1mol NaHCO3完全分解,得到的CO2分子数目为2NA C.体积为1L的1mol·L-1NaHCO3溶液中,HCO3-数目为NA D. NaCl和NH4Cl的混合物中含1mol Cl-,则混合物中质子数为28NA |
|||
答案 |
D |
|||
| 题号 | 12 |
|
|||||||||||||||
出处 |
2023广东 | ||||||||||||||||
| 题干 |
|
||||||||||||||||
答案 |
A |
||||||||||||||||
| 题号 | 13 |
|
||
出处 |
2023广东 | |||
| 题干 | 利用活性石墨电极电解饱和食盐水,进行如图所示实验。闭合K1,一段时间后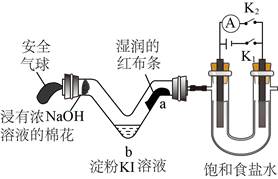 A. U型管两侧均有气泡冒出,分别是Cl2和O2 B. a处布条褪色,说明Cl2具有漂白性 C. b处出现蓝色,说明还原性:Cl->I- D.断开K1,立刻闭合K2,电流表发生偏转 |
|||
答案 |
D |
|||
| 题号 | 14 |
|
||
出处 |
2023广东 | |||
| 题干 | 化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是 A.元素电负性:E>Y>Z B.氢化物沸点:M>Y>E C.第一电离能:X>E>Y D.YZ3和YE3-的空间结构均为三角锥形 |
|||
答案 |
A | |||
| 题号 | 15 |
|
||
出处 |
2023广东 | |||
| 题干 | 催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是 P(g)。反应历程(下图)中,M为中间产物。其它条件相同时,下列说法不正确的是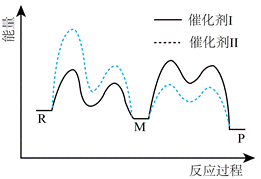 A.使用Ⅰ和Ⅱ,反应历程都分4步进行 B.反应达平衡时,升高温度,R的浓度增大 C.使用Ⅱ时,反应体系更快达到平衡 D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大 |
|||
答案 |
C |
|||
| 题号 | 16 |
|
||
出处 |
2023广东 | |||
| 题干 | 用一种具有“卯榫”结构的双极膜组装电解池(下图),可实现大电流催化电解KNO3溶液制氨。工作时,H2O在双极膜界面处被催化解离成H+和OH-,有利于电解反应顺利进行。下列说法不正确的是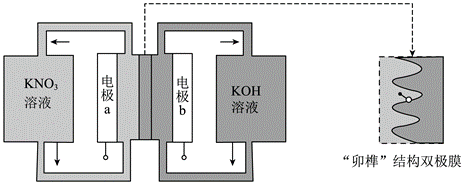 A.电解总反应:KNO3+3H2O=NH3•H2O+2O2↑+KOH B.每生成1molNH3•H2O,双极膜处有9mol的H2O解离 C.电解过程中,阳极室中KOH的物质的量不因反应而改变 D.相比于平面结构双极膜,“卯榫”结构可提高氨生成速率 |
|||
答案 |
B | |||
| 题号 | 17 |
|
||||||||||||||||
出处 |
2023广东 | |||||||||||||||||
| 题干 | 化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=cρV总∙ΔT计算获得。 (1)盐酸浓度的测定:移取20.00mL待测液,加入指示剂,用0.5000mol·L-1NaOH溶液滴定至终点,消耗NaOH溶液22.00mL。 ①上述滴定操作用到的仪器有___________。 A. 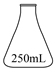 B. B.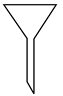 C. C.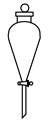 D. D.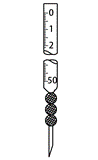 ②该盐酸浓度为___________mol·L-1。 (2)热量的测定:取上述NaOH溶液和盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为___________J (c和ρ分别取4.18 J∙g-1∙℃-1和1.0 g∙mL-1,忽略水以外各物质吸收的热量,下同)。 (3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)=FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
②ΔH=___________(选择表中一组数据计算)。结果表明,该方法可行。 (4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+ Fe2(SO4)3(aq)=3FeSO4(aq)的焓变。 查阅资料:配制Fe2(SO4)3溶液时需加入酸。加酸的目的是___________。 提出猜想:Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。 验证猜想:用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和___________(用离子方程式表示)。 实验小结:猜想成立,不能直接测反应A的焓变。 教师指导:鉴于以上问题,特别是气体生成带来的干扰,需要设计出实验过程中无气体生成的实验方案。 优化设计:乙同学根据相关原理,重新设计了优化的实验方案,获得了反应A的焓变。该方案为___________。 (5)化学能可转化为热能,写出其在生产或生活中的一种应用___________。 |
|||||||||||||||||
答案 |
(1)①AD ②0.5500 (2)418(T1-T0) (3)①> ②-20.9(b-a)kJ·mol-1或-41.8(c-a)kJ·mol-1 (4)①抑制Fe3+水解 ②Fe+2H+=Fe2+H2↑ ③.将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应热,计算得到反应Cu+ Fe2(SO4)3=CuSO4+2FeSO4的焓变ΔH1;根据(3)中实验计算得到反应Fe+ CuSO4=Cu+FeSO4的焓变ΔH2;根据盖斯定律计算得到反应Fe+ Fe2(SO4)3=3FeSO4的焓变为ΔH1+ΔH2 (5)燃料燃烧(或铝热反应焊接铁轨等) |
|||||||||||||||||
| 题号 | 18 |
|
||||||||||||
出处 |
2023广东 | |||||||||||||
| 题干 | Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下: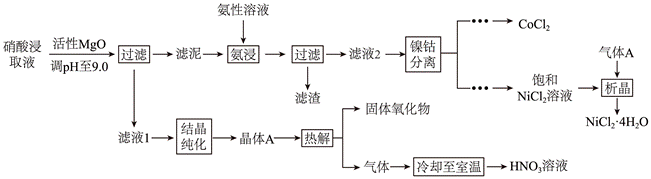 已知:氨性溶液由NH3•H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子:lgKb(NH3•H2O)=4.7;Co(OH)2易被空气氧化为Co(OH)3;部分氢氧化物的Ksp如下表。
(1)活性MgO可与水反应,化学方程式为___________。 (2)常温下,pH=9.9的氨性溶液中,c(NH3•H2O) ___________c(NH4+) (填“>”“<”或“=”)。 (3)“氨浸”时,由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为___________。 (4)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了NH4Al(OH)2CO3的明锐衍射峰。 ①NH4Al(OH)2CO3属于___________(填“晶体”或“非晶体”)。 ②(NH4)2CO3提高了Ni、Co的浸取速率,其原因是___________。 (5)①“析晶”过程中通入的酸性气体A为___________。 ②由CoCl2可制备AlxCoOy晶体,其立方晶胞如图。Al与O最小间距大于Co与O最小间距,x、y为整数,则Co在晶胞中的位置为___________;晶体中一个Al周围与其最近的O的个数为___________。 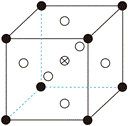 (6)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得HNO3溶液中n(HNO3)与n(H2O)的比值,理论上最高为___________。 ②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用HNO3和___________(填化学式)。 |
|||||||||||||
答案 |
(1)MgO+H2O=Mg(OH)2 (2)> (3)2Co(OH)3+12NH3ˑH2O+SO32-=2[Co(NH3)6]2++SO42-+13H2O+4OH- 或2Co(OH)3+8NH3ˑH2O+4NH4++SO32-=2[Co(NH3)6]2++SO42-+13H2O (4)①晶体 ②减少胶状物质对镍钴氢氧化物的包裹,增加了滤泥与氨性溶液的接触面积 (5)①HCl ②体心 ③. 12 (6)①0.4或2:5 ②MgO |
|||||||||||||
| 题号 | 19 |
|
||||||||||||||||
出处 |
2023广东 | |||||||||||||||||
| 题干 | 配合物广泛存在于自然界,且在生产和生活中都发挥着重要作用。 (1)某有机物R能与Fe2+形成橙红色的配离子[FeR3]2+,该配离子可被HNO3氧化成淡蓝色的配离子[FeR3]3+。 ①基态Fe2+的3d电子轨道表示式为___________。 ②完成反应的离子方程式:NO3-+2[FeR3]2++3H+  +2[FeR3]3++H2O +2[FeR3]3++H2O(2)某研究小组对(1)中②的反应进行了研究。 用浓度分别为2.0mol·L-1、2.5 mol·L-1、3.0 mol·L-1的HNO3溶液进行了三组实验,得到c([FeR3]2+)随时间t的变化曲线如图。 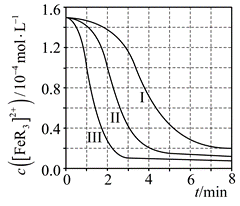 ①c(HNO3)=3.0 mol·L-1时,在0~1min内,[FeR3]2+的平均消耗速率=___________。 ②下列有关说法中,正确的有___________。 A.平衡后加水稀释,c([FeR3]2+): c([FeR3]3+)增大 B.[FeR3]2-平衡转化率:αⅢ>αII>αI C.三组实验中,反应速率都随反应进程一直减小 D.体系由橙红色转变为淡蓝色所需时间:tⅢ>tII>tI (3)R的衍生物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡: M+L  ML K1 ML K1ML+L  ML2 K2 ML2 K2研究组配制了L起始浓度c0(L)=0.02mol·L-1、M与L起始浓度比c0(M)/ c0(L)不同的系列溶液,反应平衡后测定其核磁共振氢谱。配体L上的某个特征H在三个物种L、ML、ML2中的化学位移不同,该特征H对应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
①c0(M)/ c0(L)=a时,x= ___________。 ②c0(M)/ c0(L)=b时,平衡浓度比c平(ML2): c平(ML)=___________。 (4)研究组用吸收光谱法研究了(3)中M与L反应体系。当c0(L)=1.0×10-5mol·L-1时,测得平衡时各物种c平/ c0(L)随c0(M)/ c0(L)的变化曲线如图。c0(M)/ c0(L)=0.51时,计算M的平衡转化率___________(写出计算过程,结果保留两位有效数字)。  |
|||||||||||||||||
答案 |
(1) ①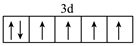 ②HNO2 ②HNO2 (2) ①5×10-5mol·L-1·min-1 ②A、B (3) ①0.36 ②3:4或0.75 (4)98% |
|||||||||||||||||
| 题号 | 20 |
|
||||||||||||
出处 |
2023广东 | |||||||||||||
| 题干 | 室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。一种基于CO、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):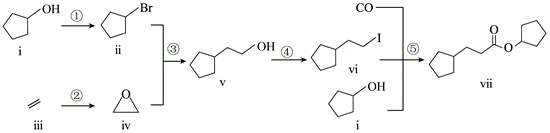 (1)化合物i的分子式为___________。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为___________(写一种),其名称为___________。 (2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为100%。y为___________。 (3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
A.反应过程中,有C-I键和H-O键断裂 B.反应过程中,有C=O双键和C-O单键形成 C.反应物i中,氧原子采取sp3杂化,并且存在手性碳原子 D. CO属于极性分子,分子中存在由p轨道“头碰头”形成的π键 (5)以苯、乙烯和CO为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。 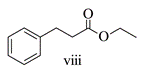 基于你设计的合成路线,回答下列问题: (a)最后一步反应中,有机反应物为___________(写结构简式)。 (b)相关步骤涉及到烯烃制醇反应,其化学方程式为___________。 (c)从苯出发,第一步的化学方程式为___________(注明反应条件)。 |
|||||||||||||
答案 |
(1)①C5H10O ②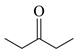 (或 (或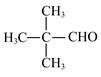 或 或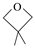 ) ③. 3-戊酮(或2,2-二甲基丙醛或3,3-二甲基氧杂环丁烷) ) ③. 3-戊酮(或2,2-二甲基丙醛或3,3-二甲基氧杂环丁烷) (2)O2或氧气 (3)①浓硫酸,加热 ② 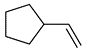 ③O2、Cu,加热(或酸性KMnO4溶液) ④ 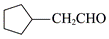 (或 (或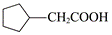 ) ) (4)CD (5)① 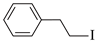 和CH3CH2OH 和CH3CH2OH ② 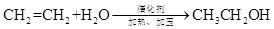 ③ 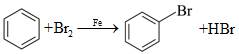 |
|||||||||||||
| v福建省实践教学工作室 蔡实践 设计制作 v |