 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 泉州市2024届高中毕业班质量监测(一) | |
|---|---|
| 本卷共有试题:14 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 明代《本草纲目》记载了烧酒的制造工艺,下列有关说法错误的是 A.“惟以粳米或大麦蒸熟”,该过程不涉及化学变化 B.“和曲酿瓮中七日”,其中的“曲”为催化剂 C.“以甑蒸取”,其中“甑”的作用类似于蒸馏烧瓶 D.“凡酸坏之酒...”,可能是乙醇被氧化成乙酸 |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 拉洛尔(W)是一种甲型肾上腺受体阻断剂,常用于治疗高血压,可通过以下反应合成: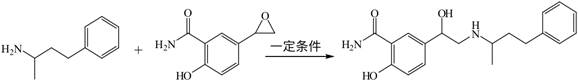 X Y W以下分析正确的是 A.X分子式为C10H14N B.Y能发生水解反应和消去反应 C.W分子中所有碳原子可能共平面 D.W可与HCl反应生成盐酸盐 |
|||
答案 |
D |
|||
| 题号 | 3 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 化学可以提高人们的生活质量。下列相关方程式错误的是 A.氢氟酸雕刻玻璃:SiO2 + 4HF=SiF4↑+ 2H2O B.泡沫灭火器:2Al3+ + 3CO32-+ 3H2O=3CO2↑ + 2Al(OH)3↓ C.制镜:RCHO + 2Ag(NH3)2OH  RCOONH4 + 2Ag↓+ 3NH3 + H2O RCOONH4 + 2Ag↓+ 3NH3 + H2O D.管道疏通剂(苛性钠、铝粉):2Al+ 2OH-+ 2H2O=2AlO2-+ 3H2↑ |
|||
答案 |
B | |||
| 题号 | 4 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 有一种离子液体电解液,有望提高某种离子电池的安全性,其结构如图所示。X、Y、Z、M、W为原子序数依次增大的短周期主族元素,X、Y、Z同周期,下列说法正确的是 A.元素第一电离能:X<Y<Z B.M与Z可形成离子化合物 C.简单氢化物沸点:Z>Y>X D.WY3分子的空间构型为三角锥形 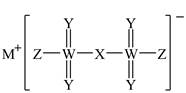 |
|||
答案 |
B | |||
| 题号 | 5 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | NA为阿伏伽德罗常数的值,下列说法错误的是 A.标准状况下,11.2L C2H4含有σ键数目为2.5NA B.3.4g CH318OH中含有的中子数为1.6NA C.0.1mol·L-1 酸性K2 Cr2O7溶液中,Cr2O27-数目小于0.1NA D.常温下,7.1g Cl2 与足量NaOH溶液反应转移的电子数为0.1NA |
|||
答案 |
C | |||
| 题号 | 6 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 一种水系Zn可充电超级电池放电时原理如图所示,下列说法错误的是 A.放电时,电解质中的c(OH-)保持不变 B.放电时,电极a为正极 C.充电时,消耗1mol Zn(OH)24-电路中转移电子数为2NA D.充电时,阳极反应式:MX + OH--e-=MX(OH) |
|||
答案 |
A |
|||
| 题号 | 7 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | NaClO2(亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备NaClO2的流程如图所示,下列说法错误的是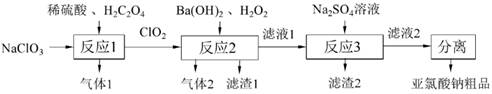 A.NaClO2的漂白原理与O3 相似 B.气体1、气体2分别是CO2、O2 C.反应3的离子方程式:Ba2+ + SO24-=BaSO4↓ D.“分离”操作过程包括结晶、过滤、乙醇洗涤等 |
|||
答案 |
D | |||
| 题号 | 8 |
|
|||||||||||||||
出处 |
2024泉州一检 | ||||||||||||||||
| 题干 | 下列实验方法或操作能达到相应实验目的的是
|
||||||||||||||||
答案 |
C |
||||||||||||||||
| 题号 | 9 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的含Ru(Ⅱ)催化剂[L—Ru—NH3]+,能高效电催化氧化NH3 合成N2H4,其电极反应机理如图所示。下列说法错误的是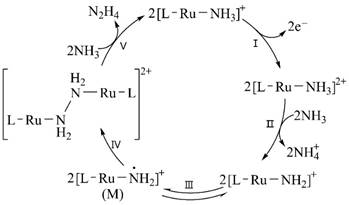 A.NH +4与N2H4中的N原子杂化方式相同 B.反应Ⅰ为:[L—Ru—NH3]+ -e-=[L—Ru—NH3]2+ C.反应Ⅱ发生了氧化还原反应 D.M中Ru的化合价为+2 |
|||
答案 |
C | |||
| 题号 | 10 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 室温下,0.1mol·L-1 NaOH溶液滴定盐酸酸化的0.02mol·L-1FeCl3溶液的pH-t 曲线如图所示。下列说法正确的是 已知:①室温时Ksp[Fe(OH) 3]=4.0×10-38 ②lg2=0.3 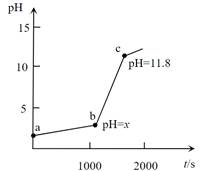 A.Fe3+的水解平衡常数Kh= 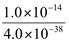 B.若b点c(Fe3+)=10-5mol·L-1,则x=3.2 C.ab段仅发生反应:Fe3+ + 3OH-=Fe(OH) 3↓ D.从a到c点,水的电离程度一直在减小 |
|||
答案 |
B | |||
| 题号 | 11 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 锂是高能电池的主要原材料。工业上以Li2CO3为锂源制备LiFePO4,从盐湖水(含有NaCl、LiCl、MgCl2、Na2B4O7等物质)中提炼Li2CO3的工艺流程如图所示。 盐酸Na2CO3溶液Ca(OH)2饱和Na2CO3溶液 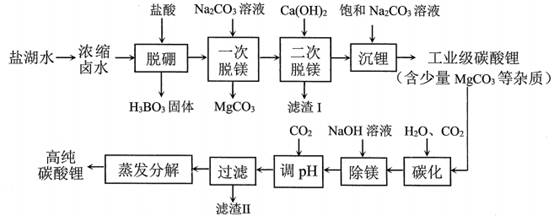 已知H3BO3与足量NaOH溶液反应生成Na[B(OH)4],则H3BO3为 元酸。 滤渣I的成分是 (填化学式)“碳化”中碳酸锂转化为 (填化学式) 已知在不同温度下“蒸发分解”,碳酸锂的产率与碳酸锂溶解度关系如图: 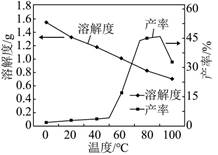 90℃以下,随温度升高,碳酸锂产率升高的原因可能是 . 工业上以高纯碳酸锂、磷酸铁、炭黑(C)为原料,通过高温煅烧的方法制得LiFePO4反应的化学方程式为 。 LiFePO4是锂离子电池重要正极材料,晶胞结构示意图如图(a)所示。其中О围绕Fe和Р分别形成正⼋面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有 个。 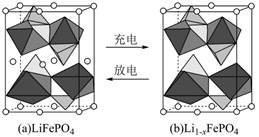 电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,其结构示意图如图(b)所示,则x= 。 |
|||
答案 |
(1)B4O72- + 2H+ + 5H2O=4H3BO3↓ (2)一 Mg(OH)2、CaCO3 LiHCO3 碳酸氢锂分解率随温度升高而增加,碳酸锂的溶解度随温度升高而降低 Li2CO3 + 2FePO4 + 2C  2LiFePO4 + 3CO ↑ 2LiFePO4 + 3CO ↑或2Li2CO3 + 4FePO4 + C  4LiFePO4 + 3CO2↑ 4LiFePO4 + 3CO2↑(7)4;0.5 |
|||
| 题号 | 12 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 三氯化铬(CrCl3)是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。 已知:COCl2沸点为8.2℃,有毒,易水解回答下列问题: 基态铬原子核外电子排布式为 ,三氯化铬固体的晶体类型为 。 “热分解”发生反应的化学方程式为 。 “热反应”制无水CrCl3 的实验装置如图所示(A、D中加热装置略)。 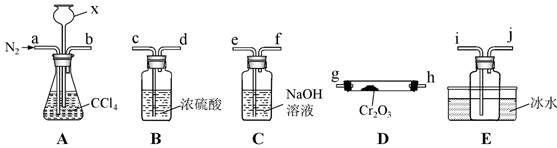 ①实验装置连接顺序为b→__,__→__,__→__,__→__(填仪器接⼝字⺟) ②加热反应前通N2的目的是 。 E中收集的物质含有 。(写化学式) A中仪器x的名称是 ,其作用是 。 ⑤尾气经 处理后可循环使用 已知CrCl3·6H2O配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如[Cr(H2O)5Cl]Cl2·H2O晶体为淡绿色。将CrCl3溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的AgNO3溶液,得 到2.87g白色沉淀。 ①[Cr(H2O)5Cl]Cl2·H2O中存在的化学键有 。 a.配位键b.氢键c.离子键d.金属键 ②该暗绿色晶体的化学式为 。 |
|||
答案 |
(1)[Ar]3d54s1 (或1s22s22p63s23p63d54s1) 分子晶体) (2)(NH4) 2Cr2O7  N2↑ + Cr2O3 + 4H2O ↑ N2↑ + Cr2O3 + 4H2O ↑(3)①b→g,h(或h,g)→i,j→c,d→e ②排出装置内的空气,防止CrCl3被空气中O2氧化 ③长颈漏斗 平衡气压,防止堵塞 ④CrCl3、CCl4、COCl2 ⑤干燥(或除水) (4)①a,c ②[Cr(H2O)4Cl2]Cl·H2O |
|||
| 题号 | 13 |
|
||||||||
出处 |
2024泉州一检 | |||||||||
| 题干 | 科学家研究发现CH3I热裂解时主要发生如下反应: 反应ⅰ:2CH3I(g)  2HI(g) + C2H4(g) ΔH1=+80.2kJ·mol-1 2HI(g) + C2H4(g) ΔH1=+80.2kJ·mol-1反应ⅱ:2C2H4(g)  C4H8(g) ΔH2=-84kJ·mol-1 C4H8(g) ΔH2=-84kJ·mol-1反应ⅲ:3C2H4(g)  2C3H6(g) ΔH3=-108kJ·mol-1 2C3H6(g) ΔH3=-108kJ·mol-1反应ⅳ:2HI(g)  H2(g) + I2 (g) ΔH4=+11kJ·mol-1 H2(g) + I2 (g) ΔH4=+11kJ·mol-1回答下列问题: (1)反应3 CH3I (g)  C3H6(g)+3HI(g) ΔH =_________kJ·mol-1 C3H6(g)+3HI(g) ΔH =_________kJ·mol-1(2)在密闭刚性容器中投料1mol CH3I(g),若只发生反应ⅰ、ⅱ、ⅲ,平衡总压强为p MPa,温度对平衡体系中乙烯、丙烯和丁烯物质的量分数的影响如下图甲所示。 ①随温度升高,C3H6物质的量分数先增大后减小的原因是_________。 ②CH3I(g)转化率α(A)_________α(B)(填“>” “<”或“=”); 715K时,反应ⅰ平衡常数Kp=_________MPa(列计算式)。 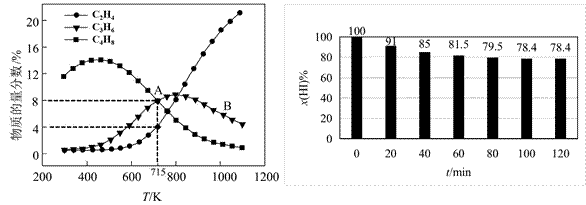 图甲 图乙 (3)反应ⅳ的相关信息如下表:
②研究反应ⅳ发现:v 正=ka·x(H2)·x(I2),v 逆=kb·x2(HI),其中ka、kb为常数。在某温度下,向刚性密闭容器中充入一定量的HI(g),碘化氢的物质的量分数x(HI)与反应时间t的关系如上图乙所示。 0~ 40min,反应的平均速率v(HI)=_________min-1(用单位时间内物质的量分数的变化表示)。该温度下,反应ⅳ的Ka/Kb=________(列计算式)。 |
|||||||||
答案 |
(1) +66.3(或66.3) (2) ①反应i为吸热反应,温度升高,反应i平衡向正向移动,乙烯浓度增大,使得反应ii平衡正向移动;反应ii为放热反应,温度升高,反应ii平衡向逆向移动;低于800K,乙烯浓度对反应ii的影响占主导,高于800K,温度对反应ii的影响占主导。因此,丙烯的物质的量分数先增大后减小。 ②< 或0.64p (3)①299;162.1;②0.00375(或3.75×10-3、3/800) |
|||||||||
| 题号 | 14 |
|
||
出处 |
2024泉州一检 | |||
| 题干 | 维生素B6在自然界分布广泛,是维持蛋白质正常代谢必要的水溶性维生素,以乙氧基乙酸乙酯为原料合成维生素B6的路线如下: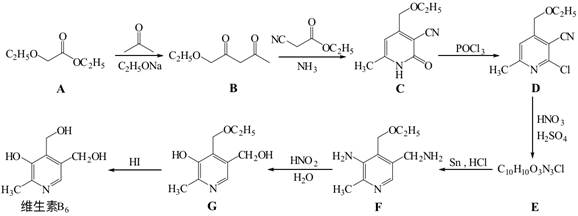 回答以下问题: (1)维生素B6易溶于水的原因是 (2)A中官能团的名称为 , 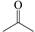 的名称为 。 的名称为 。A→B的有机反应类型为 。 已知C与POCl3按物质的量比为3:1反应生成D,该反应的无机产物是 。 (5)E的结构简式为 (6)G→维生素B6的化学方程式为 。 (7)C的同分异构体中,写出一种符合下列要求的有机物结构简式 ①苯环上有4个取代基 ②只有2种官能团,其中一种显碱性 ③核磁共振氢谱有4组峰 |
|||
答案 |
(1)维生素B6可以与水形成分子间氢键 (2)醚键、酯基;丙酮 (3)取代反应 (4)H3PO4或PO(OH)3 (5) 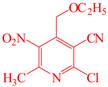 (6) 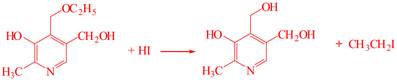 (7) 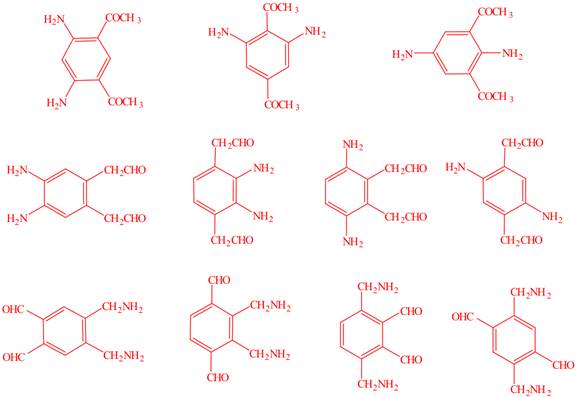 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |