 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2019年福建省高三毕业班质量检查测试化学试卷 | |
|---|---|
| 本卷共有试题:12 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 2019年是“国际化学元素周期表年”。下列有关“At”“Ga”“Ce”“F”等元素的说法错误的是 A.砹(At)属于过渡元素 B.门捷列夫预言的“类铝”—镓(Ga)元素的发现,证实了元素周期律的科学性 C. 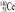 原子核内的中子数为82 原子核内的中子数为82D.含氟牙膏预防龋齿的原理是F-在牙齿表面生成抗酸性更强的物质 |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 福建水仙花含有芳樟醇,其结构如右下图所示。下列有关芳樟醇的说法错误的是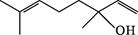 A.能发生取代反应和加成反应 B.可以和NaOH溶液发生反应 C.可作合成高分子化合物的原料(单体) D.与 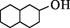 互为同分异构体 互为同分异构体 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 某同学模拟2019年春晚节目“魔壶”进行实验。将“魔壶”中盛有的FeCl3溶液依次倒入分别盛有约1 mL①KSCN②AgNO3③NaOH浓溶液的3个烧杯中,实验现象各异。下列有关说法正确的是 A.烧杯①中,有血红色沉淀生成 B.烧杯②中,发生了氧化还原反应 C.烧杯③中,反应后所得分散系属于胶体 D.若用FeCl2代替FeCl3进行上述实验,实验现象依然各异 |
|||
答案 |
D | |||
| 题号 | 4 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 用下列装置进行相应实验,不能达到实验目的的是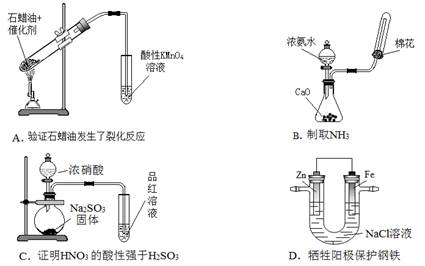 |
|||
答案 |
C | |||
| 题号 | 5 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 短周期主族元素X、Y、Q、R、W的原子序数依次增大,X与Q、Y与W分别同主族,X、Y、Q原子的电子层数之和为6且最外层电子数之和为8,Q的焰色反应呈黄色。下列说法正确的是 A.简单离子半径:Q>W>Y B.Y的单质能与X、Q、R、W的单质发生反应 C.单质的沸点:Y>W D.工业上,Q、R的单质都采用电解熔融氯化物的方法制取 |
|||
答案 |
B | |||
| 题号 | 6 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 利用如右下图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是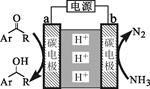 A.a为阴极 B.b电极反应式为2NH3-6e-=N2+ 6H+ C.电解一段时间后,装置内H+数目增多 D.每消耗1 molNH3,理论上可生成1.5 mol  |
|||
答案 |
C | |||
| 题号 | 7 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液的pH与V(NaOH)的关系如图1所示;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下列判断正确的是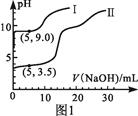 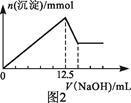 A.图1中的曲线II表示MgSO4与NaOH反应的关系 B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32 C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大 D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系 |
|||
答案 |
C | |||
| 题号 | 8 |
|
||||
出处 |
2019福建质检 | |||||
| 题干 | 碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。 制取碘酸(HIO3)的实验装置示意图和有关资料如下:
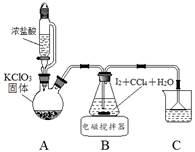 回答下列问题: 步骤Ⅰ用Cl2氧化I2制取HIO3 (1)装置A中发生反应的化学方程式为 。 (2)装置B中的CCl4可以加快反应速率,原因是 。 (3)反应结束后,获取HIO3溶液的操作中,所需玻璃仪器有烧杯、 和 。 步骤Ⅱ用KOH中和HIO3制取KIO3 (4)该中和反应的离子方程式为 。中和之前,应将上述HIO3溶液煮沸至接近无色,否则中和时易生成 (填化学式)而降低KIO3的产量。 (5)往中和后的溶液中加入适量,经搅拌、静置、过滤等操作,得到白色固体。 (6)为验证产物,取少量上述固体溶于水,滴加适量SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的SO2饱和溶液过量,则无蓝色出现,原因是 。 步骤Ⅲ纯度测定 (7)取0.1000 g产品于碘量瓶中,加入稀盐酸和足量KI溶液,用0.1000mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗Na2S2O3溶液的体积为24.00 mL。则产品中KIO3的质量分数为 。[M(KIO3)=214.0g·mol-1] |
|||||
答案 |
(1)KClO3+ 6HCl(浓)=KCl+ 3Cl2↑+ 3H2O (2)I2和Cl2易溶于CCl4,增大了反应物浓度 (3)分液漏斗玻璃棒 (4)HIO3+ OH-=IO3-+ H2O;KIO4 (5)乙醇(或“酒精”“C2H5OH” (6)过量的SO2将IO3-(或I2)还原为I- (或“3SO2+ IO3-+ 3H2O=I-+ 3SO42-+ 6H+” 或“SO2+ I2+ 2H2O=2I-+ SO42-+ 4H+”等其他合理答案) (7)85.6% |
|||||
| 题号 | 9 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 利用脆硫铅锑矿(主要成分为Pb4FeSb6S14)制取锑白(Sb2O3)的湿法冶炼工艺流程如下图所示。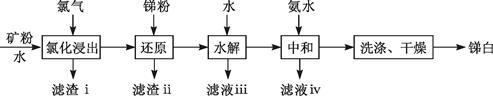 已知:①锑(Sb)为ⅤA族元素,Sb2O3为两性氧化物; ②“水解”时锑元素转化为SbOCl沉淀; ③Ksp[Fe(OH)2]=8.0×10-16 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38mol4·L-4 回答下列问题: (1)“氯化浸出”后的滤液中含有两种锑的氯化物,分别为SbCl3和(填化学式) 。滤渣ⅰ中所含的反应产物有PbCl2和一种单质,该单质是 。 (2)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为 ,该转化有利于“水解”时锑铁分离,理由是 。 (3)“还原”用的Sb可由以下方法制得:用Na2S—NaOH溶液浸取辉锑精矿(Sb2S3),将其转化为Na3SbS3(硫代亚锑酸钠)—NaOH溶液。按下图所示装置电解后,阴极上得到Sb,阴极区溶液重新返回浸取作业,阴极的电极反应式为 。该装置中,隔膜是 (填“阳”或“阴”)离子交换膜。 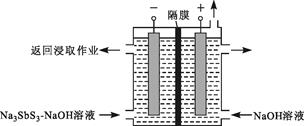 (4)“中和”时若用NaOH溶液代替氨水,Sb2O3可能会转化为 (填离子符号),使锑白的产量降低。 (5)锑白也可用火法冶炼脆硫铅锑矿制取,该法中有焙烧、烧结、还原和吹炼等生产环节。与火法冶炼相比,湿法冶炼的优点有 (任写一点)。 |
|||
答案 |
(1)SbCl5;硫(或“S”等其他合理答案) (2)Sb + 3Fe3+=3Fe2+ + Sb3+ Fe2+比Fe3+更不易水解生成沉淀 (3)SbS33-+ 3e-=Sb + 3S2-;阳 (4)SbO33-(或“[Sb(OH)4]-”“SbO2-”) (5)能耗低(或“安全性高”等其他合理答案) |
|||
| 题号 | 10 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 氧气是一种常见的氧化剂,用途广泛。回答下列问题: (1)用H2O2制取O2时,分解的热化学方程式为: 2H2O2(aq)=2H2O(l) +O2(g) ΔH= akJ·mol-1 ①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是 (填标号)。 A.反应速率 B.反应热 C.活化能 D.生成物 ②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为: H2O2(aq) + 2Fe3+(aq)=2Fe2+(aq) +O2(g) +2H+(aq)ΔH=bkJ·mol-1 第二步反应的热化学方程式为。 (2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g)  2Cl2(g) + 2H2O(g)]。将1 molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如右图所示。 2Cl2(g) + 2H2O(g)]。将1 molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如右图所示。 ①该反应的速率v= k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是 (填标号)。 A.使用催化剂,k不变 B.温度升高,k增大 C.平衡后分离出水蒸气,k变小 D.平衡后再充入1molO2和4molHCl,反应物转化率都增大 ②T1T2(填“>”或“<”)。该反应的ΔH 0(填“>”或“<”),判断的依据是 。 ③T2时,HCl的平衡转化率= ,反应的Kx= (Kx为以物质的量分数表示的平衡常数)。 |
|||
答案 |
(1)①BD;②H2O2(aq) +2Fe2+(aq) +2H+(aq)=2Fe3+(aq)+2H2O(l) ΔH= (a-b)kJ·mol-1 (2)①BD;②<;< T1、T2的平衡体系中气体减少量分别为n(T1)= 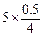 =0.625mol =0.625moln(T2)= 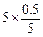 =0.5mol,所以T1平衡时转化率更大 =0.5mol,所以T1平衡时转化率更大③50% ;  |
|||
| 题号 | 11 |
|
||
出处 |
2019福建质检 | |||
| 题干 | Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。 回答下列问题: (1)Ca小于Ti的是 (填标号)。 A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能 (2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。 ①Cl2O2的沸点比H2O2低,原因是 。 ②O3分子中心原子杂化类型为 ;O3是极性分子,理由是 。 (3)Na3OCl可由以下两种方法制得: 方法Ⅰ Na2O + NaCl  Na3OCl Na3OCl方法II 2Na + 2NaOH + 2NaCl  2Na3OCl + H2↑ 2Na3OCl + H2↑①Na2O的电子式为 。 ②在方法Ⅱ的反应中,形成的化学键有 (填标号)。 A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键 (4)Na3OCl晶体属于立方晶系,其晶胞结构如右下图所示。已知:晶胞参数为a nm,密度为dg·cm-3。 ①Na3OCl晶胞中,Cl位于各顶点位置,Na位于 位置,两个Na之间的最短距离为 nm。 ②用a、d表示阿伏加德罗常数的值NA= (列计算式)。 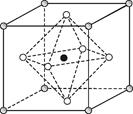 |
|||
答案 |
(1)B (2)①H2O2分子间存在氢键 ②sp2;O3分子为V形结构(或“O3分子中正负电荷重心不重合”等其他合理答案) (3)① 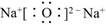 ;②B ;②B(4)①面心; 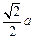 ;② ;②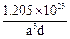 |
|||
| 题号 | 12 |
|
||
出处 |
2019福建质检 | |||
| 题干 | 丁香酚存在于丁香花的花蕊中,以丁香酚为原料制取有机物F的路线如下: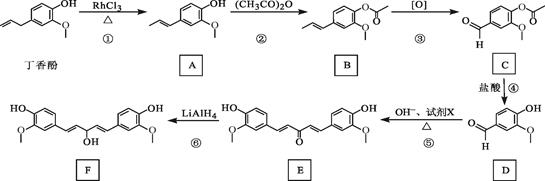 已知:  (1)丁香酚的分子式为; (2)A中的含氧官能团是(填名称),②的反应类型为。 (3)写出满足下列条件的C的所有同分异构体的结构简式。 ①含苯环且环上只有两个取代基; ②属于酯类化合物; ③核磁共振氢谱有3组峰,且峰面积之比为3∶1∶1。 (4)1 mol D最多可以与molH2发生加成反应。 (5)反应⑤中,试剂X的结构简式为。 (6)设计用呋喃甲醛( 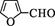 )和环己醇为原料制取 )和环己醇为原料制取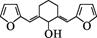 的合成路线(无机试剂任选) 的合成路线(无机试剂任选) |
|||
答案 |
(1)C10H12O2 (2)羟基、醚键 取代反应 (3) 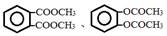 (4)4 (5) 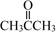 (6) 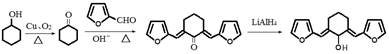 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |