A.砹(At)属于过渡元素
B.门捷列夫预言的“类铝”—镓(Ga)元素的发现,证实了元素周期律的科学性
C.
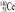 原子核内的中子数为82
原子核内的中子数为82D.含氟牙膏预防龋齿的原理是F-在牙齿表面生成抗酸性更强的物质
2.福建水仙花含有芳樟醇,其结构如右下图所示。下列有关芳樟醇的说法错误的是
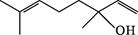
A.能发生取代反应和加成反应
B.可以和NaOH溶液发生反应
C.可作合成高分子化合物的原料(单体)
D.与
 互为同分异构体
互为同分异构体3.某同学模拟2019年春晚节目“魔壶”进行实验。将“魔壶”中盛有的FeCl3溶液依次倒入分别盛有约1 mL①KSCN②AgNO3③NaOH浓溶液的3个烧杯中,实验现象各异。下列有关说法正确的是
A.烧杯①中,有血红色沉淀生成
B.烧杯②中,发生了氧化还原反应
C.烧杯③中,反应后所得分散系属于胶体
D.若用FeCl2代替FeCl3进行上述实验,实验现象依然各异
4.用下列装置进行相应实验,不能达到实验目的的是
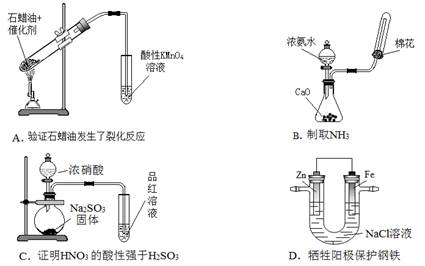
5.短周期主族元素X、Y、Q、R、W的原子序数依次增大,X与Q、Y与W分别同主族,X、Y、Q原子的电子层数之和为6且最外层电子数之和为8,Q的焰色反应呈黄色。下列说法正确的是
A.简单离子半径:Q>W>Y
B.Y的单质能与X、Q、R、W的单质发生反应
C.单质的沸点:Y>W
D.工业上,Q、R的单质都采用电解熔融氯化物的方法制取
6.利用如右下图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是
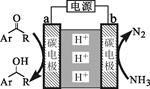
A.a为阴极
B.b电极反应式为2NH3-6e-=N2+ 6H+
C.电解一段时间后,装置内H+数目增多
D.每消耗1 molNH3,理论上可生成1.5 mol
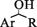
7.常温下,用0.1mol·L-1MgSO4和0.05mol·L-1Al2(SO4)3溶液进行实验:①各取25mL,分别滴加0.5mol·L-1NaOH溶液,测得溶液的pH与V(NaOH)的关系如图1所示;②将两种溶液等体积混合后,取出25mL,逐滴加入上述NaOH溶液,观察现象。下列判断正确的是
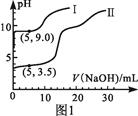
A.图1中的曲线II表示MgSO4与NaOH反应的关系
B.根据图1可得Ksp[Al(OH)3]的值大于1.0×10-32
C.实验②中Al(OH)3完全溶解前,溶液中c(Mg2+)/c(Al3+)逐渐变大
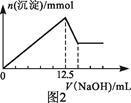
D.图2可以表示实验②中n(沉淀)与V(NaOH)的关系
8.碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
| HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
| KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3-=IO4-+ Cl- |
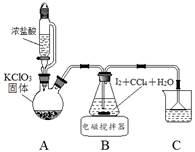
回答下列问题:
步骤Ⅰ用Cl2氧化I2制取HIO3
(1)装置A中发生反应的化学方程式为 。
(2)装置B中的CCl4可以加快反应速率,原因是 。
(3)反应结束后,获取HIO3溶液的操作中,所需玻璃仪器有烧杯、 和 。
步骤Ⅱ用KOH中和HIO3制取KIO3
(4)该中和反应的离子方程式为 。中和之前,应将上述HIO3溶液煮沸至接近无色,否则中和时易生成 (填化学式)而降低KIO3的产量。
(5)往中和后的溶液中加入适量,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量SO2饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的SO2饱和溶液过量,则无蓝色出现,原因是 。
步骤Ⅲ纯度测定
(7)取0.1000 g产品于碘量瓶中,加入稀盐酸和足量KI溶液,用0.1000mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗Na2S2O3溶液的体积为24.00 mL。则产品中KIO3的质量分数为 。[M(KIO3)=214.0g·mol-1]
9.利用脆硫铅锑矿(主要成分为Pb4FeSb6S14)制取锑白(Sb2O3)的湿法冶炼工艺流程如下图所示。
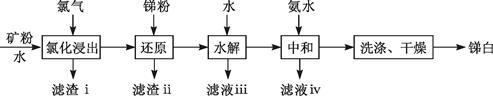
已知:①锑(Sb)为ⅤA族元素,Sb2O3为两性氧化物;
②“水解”时锑元素转化为SbOCl沉淀;
③Ksp[Fe(OH)2]=8.0×10-16 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38mol4·L-4
回答下列问题:
(1)“氯化浸出”后的滤液中含有两种锑的氯化物,分别为SbCl3和(填化学式) 。滤渣ⅰ中所含的反应产物有PbCl2和一种单质,该单质是 。
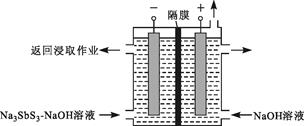
(2)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为 ,该转化有利于“水解”时锑铁分离,理由是 。
(3)“还原”用的Sb可由以下方法制得:用Na2S—NaOH溶液浸取辉锑精矿(Sb2S3),将其转化为Na3SbS3(硫代亚锑酸钠)—NaOH溶液。按下图所示装置电解后,阴极上得到Sb,阴极区溶液重新返回浸取作业,阴极的电极反应式为 。该装置中,隔膜是 (填“阳”或“阴”)离子交换膜。
(4)“中和”时若用NaOH溶液代替氨水,Sb2O3可能会转化为 (填离子符号),使锑白的产量降低。
(5)锑白也可用火法冶炼脆硫铅锑矿制取,该法中有焙烧、烧结、还原和吹炼等生产环节。与火法冶炼相比,湿法冶炼的优点有 (任写一点)。
10.氧气是一种常见的氧化剂,用途广泛。回答下列问题:
(1)用H2O2制取O2时,分解的热化学方程式为:
2H2O2(aq)=2H2O(l) +O2(g) ΔH= akJ·mol-1
①相同条件下,H2O2分解时,无论是否使用催化剂,均不会改变的是 (填标号)。
A.反应速率 B.反应热 C.活化能 D.生成物
②以Fe3+作催化剂时,H2O2的分解反应分两步进行,第一步反应为:
H2O2(aq) + 2Fe3+(aq)=2Fe2+(aq) +O2(g) +2H+(aq)ΔH=bkJ·mol-1
第二步反应的热化学方程式为。
(2)工业上用Cl2生产某些含氯有机物时产生HCl副产物,可用O2将其转化为Cl2,实现循环利用[O2(g) + 4HCl(g)
 2Cl2(g) + 2H2O(g)]。将1 molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如右图所示。
2Cl2(g) + 2H2O(g)]。将1 molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如右图所示。
①该反应的速率v= k ca(O2)·cb(HCl)(k为速率常数),下列说法正确的是 (填标号)。
A.使用催化剂,k不变
B.温度升高,k增大
C.平衡后分离出水蒸气,k变小
D.平衡后再充入1molO2和4molHCl,反应物转化率都增大
②T1T2(填“>”或“<”)。该反应的ΔH 0(填“>”或“<”),判断的依据是 。
③T2时,HCl的平衡转化率= ,反应的Kx= (Kx为以物质的量分数表示的平衡常数)。
11.Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)Ca小于Ti的是 (填标号)。
A.最外层电子数 B.未成对电子数
C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是 。
②O3分子中心原子杂化类型为 ;O3是极性分子,理由是 。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl
 Na3OCl
Na3OCl方法II 2Na + 2NaOH + 2NaCl
 2Na3OCl + H2↑
2Na3OCl + H2↑①Na2O的电子式为 。
②在方法Ⅱ的反应中,形成的化学键有 (填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
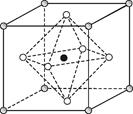
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右下图所示。已知:晶胞参数为a nm,密度为dg·cm-3。
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于 位置,两个Na之间的最短距离为 nm。
②用a、d表示阿伏加德罗常数的值NA= (列计算式)。
12.丁香酚存在于丁香花的花蕊中,以丁香酚为原料制取有机物F的路线如下:
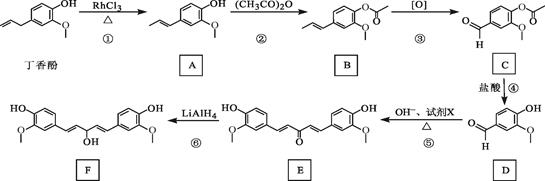
已知:

(1)丁香酚的分子式为;
(2)A中的含氧官能团是(填名称),②的反应类型为。
(3)写出满足下列条件的C的所有同分异构体的结构简式。
①含苯环且环上只有两个取代基;
②属于酯类化合物;
③核磁共振氢谱有3组峰,且峰面积之比为3∶1∶1。
(4)1 mol D最多可以与molH2发生加成反应。
(5)反应⑤中,试剂X的结构简式为。
(6)设计用呋喃甲醛(
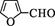 )和环己醇为原料制取
)和环己醇为原料制取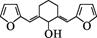 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)