 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 辽宁省2022年普通高等学校招生选择性考试 | |
|---|---|
| 本卷共有试题:19 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 北京冬奥会备受世界瞩目。下列说法错误的是 A.冰壶主材料花岗岩属于无机非金属材料 B.火炬“飞扬”使用的碳纤维属于有机高分子材料 C.冬奥会“同心”金属奖牌属于合金材料 D.短道速滑服使用的超高分子量聚乙烯属于有机高分子材料 |
|||
答案 |
B |
|||
| 题号 | 2 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 下列符号表征或说法正确的是 A.H2S电离:H2S=HS-+ H+ B.Na位于元素周期表p区 C.CO32-空间结构:平面三角形 D.KOH电子式:  |
|||
答案 |
C |
|||
| 题号 | 3 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 设NA为阿伏加德罗常数的值,下列说法正确的是 A.28g C2H4分子中含有的α键数目为4NA B.标准状况下,22.4L HCl气体中H+数目为NA C.pH=12的Na2CO3溶液中OH-数目为0.01NA D.1.8g 18O中含有的中子数为NA |
|||
答案 |
D |
|||
| 题号 | 4 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 下列关于苯乙炔(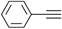 )的说法正确的是 )的说法正确的是A.不能使酸性KMnO4溶液褪色 B.分子中最多有5个原子共直线 C.能发生加成反应和取代反应 D.可溶于水 |
|||
答案 |
C |
|||
| 题号 | 5 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是 A.X能与多种元素形成共价键 B.简单氢化物沸点:Z<Q C.第一电离能:Y>Z D.电负性:W<Z |
|||
答案 |
B |
|||
| 题号 | 6 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是 A.褪色原因为I2被Fe还原 B.液体分层后,上层呈紫红色 C.镀锌铁钉比镀锡铁钉更易生锈 D.溶液恢复棕色的原因为I-被氧化 |
|||
答案 |
D | |||
| 题号 | 7 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 理论化学模拟得到一种N+13离子,结构如图。下列关于该离子的说法错误的是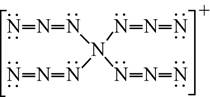 A.所有原子均满足8电子结构 B.N原子的杂化方式有2种 C.空间结构为四面体形 D.常温下不稳定 |
|||
答案 |
B |
|||
| 题号 | 8 |
|
||||||||||||||||||||
出处 |
2022辽宁高考 | |||||||||||||||||||||
| 题干 | 下列类比或推理合理的是
|
|||||||||||||||||||||
答案 |
A |
|||||||||||||||||||||
| 题号 | 9 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 如图,c管为上端封口的量气管,为测定乙酸溶液浓度,量取10.00 mL待测样品加入b容器中,接通电源,进行实验。下列说法正确的是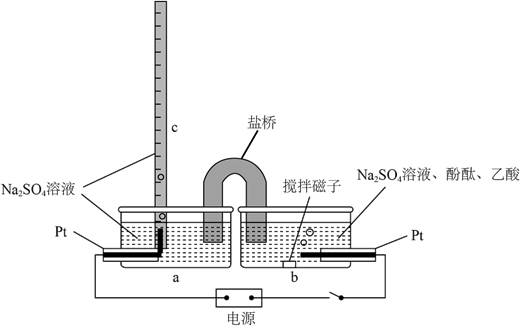 A.左侧电极反应:2H2O-4e-=O2↑+4H+ B.实验结束时,b中溶液红色恰好褪去 C.若c中收集气体11.20 mL,则样品中乙酸浓度为0.1mol·L-1 D.把盐桥换为U形铜导线,不影响测定结果 |
|||
答案 |
A | |||
| 题号 | 10 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 利用有机分子模拟生物体内“醛缩酶”催化Diels-Alder反应取得重要进展,荣获2021年诺贝尔化学奖。某Diels-Alder反应催化机理如下,下列说法错误的是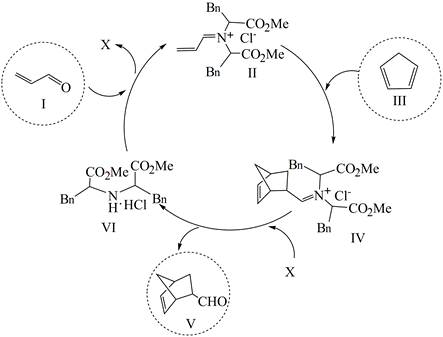 A.总反应为加成反应 B.Ⅰ和Ⅴ互为同系物 C.Ⅵ是反应的催化剂 D.化合物X为H2O |
|||
答案 |
B |
|||
| 题号 | 11 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | H2O(l)、NH3(l)均可自耦电离:2H2O(l) OH-+H3O+、2NH3(l) OH-+H3O+、2NH3(l) NH2-+NH4+。下列反应与 NH2-+NH4+。下列反应与 →CH3CH2OH+HBr原理不同的是 →CH3CH2OH+HBr原理不同的是A.Mg3N2+6H2O=3Mg(OH)2+2NH3 B.SiCl4+8NH3(l)=Si(NH2)4+4NH4Cl C.3Cl2+8NH3=6NH4Cl+N2 D.PCl3+3H2O=H3PO3+3HCl |
|||
答案 |
C | |||
| 题号 | 12 |
|
||||||||
出处 |
2022辽宁高考 | |||||||||
| 题干 | 某温度下,在1L恒容密闭容器中2.0mol X发生反应2X(s) Y(g)+2Z(g),有关数据如下: Y(g)+2Z(g),有关数据如下:
A.1 min时,Z的浓度大于0.20mol·L-1 B.2 min时,加入0.20mol Z,此时V正(Z)<V逆(Z) C.3 min时,Y的体积分数约为33.3% D.5 min时,X的物质的量为1.4 mol |
|||||||||
答案 |
B |
|||||||||
| 题号 | 13 |
|
|||||||||||||||
出处 |
2022辽宁高考 | ||||||||||||||||
| 题干 | 下列实验能达到目的的是
|
||||||||||||||||
答案 |
C |
||||||||||||||||
| 题号 | 14 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 某储能电池原理如图。下列说法正确的是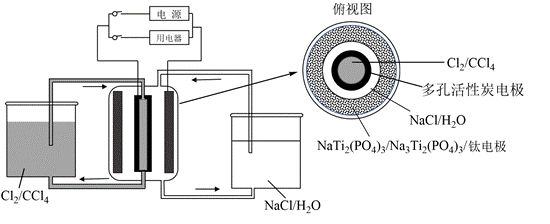 A.放电时负极反应:Na3Ti2(PO4)3-2e-=NaTi2(PO4)3+2Na+ B.放电时Cl-透过多孔活性炭电极向CCl4中迁移 C.放电时每转移1 mol电子,理论上CCl4吸收0.5mol Cl2 D.充电过程中,NaCl溶液浓度增大 |
|||
答案 |
A |
|||
| 题号 | 15 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 甘氨酸(NH2CH2COOH)是人体必需氨基酸之一,在25℃时,NH3+CH2COOH、NH3+CH2COO-和NH2CH2COO-的分布分数[如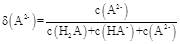 ]与溶液pH关系如图。下列说法错误的是( ) ]与溶液pH关系如图。下列说法错误的是( )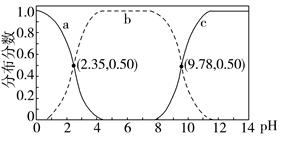 A.甘氨酸具有两性 B.曲线c代表NH2CH2COO- C.NH3+CH2COO-+H2O  NH3+CH2COOH+OH-的平衡常数K=10-11.65 NH3+CH2COOH+OH-的平衡常数K=10-11.65D.c2(NH3+CH2COO-)<c(NH3+CH2COOH)·c(NH2CH2COO-) |
|||
答案 |
D |
|||
| 题号 | 16 |
|
||||||||||||
出处 |
2022辽宁高考 | |||||||||||||
| 题干 | 某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制各BiOCl和MnSO4,工艺流程如下: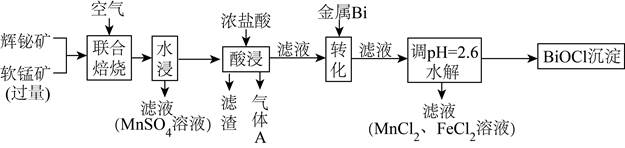 已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3; ②金属活动性:Fe>(H)>Bi>Cu; ③相关金属离子形成氢氧化物的pH范围如下:
(1)为提高焙烧效率,可采取的措施为_______。 a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度 (2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为_______。 (3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;②_______。 (4)滤渣的主要成分为_______(填化学式)。 (5)生成气体A的离子方程式为_______。 (6)加入金属Bi的目的是_______。 (7)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_______。 |
|||||||||||||
答案 |
(1)ab (2)2Bi2S3+9O2 2Bi2O3+6SO2 2Bi2O3+6SO2(3)抑制金属离子水解 (4)SiO2 (5)Mn2O3+6H++2Cl-=2Mn2++Cl2↑+3H2O (6)将Fe3+转化为Fe2+ (7)24.02% |
|||||||||||||
| 题号 | 17 |
|
|||||||||||||||||||||||||
出处 |
2022辽宁高考 | ||||||||||||||||||||||||||
| 题干 | 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:N2(g)+2H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1 ΔS=-200 J·K-1·mol-1。回答下列问题: (1)合成氨反应在常温下_______(填“能”或“不能”)自发。 (2)_______温(填“高”或“低”,下同)有利于提高反应速率,_______温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400~500 ℃。 针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。 (3)方案一:双温-双控-双催化剂。使用Fe-TiO2-2xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,Fe的温度为547℃,而TiO2-2xHy的温度为415℃)。  下列说法正确的是_______。 a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率 b.N≡N在“热Fe”表面断裂,有利于提高合成氨反应速率 c.“热Fe”高于体系温度,有利于提高氨的平衡产率 d.“冷Ti”低于体系温度,有利于提高合成氨反应速率 (4)方案二:M-LiH复合催化剂。 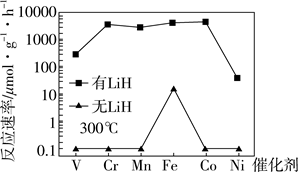 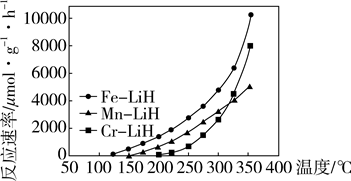 下列说法正确的是_______。 a.300℃时,复合催化剂比单一催化剂效率更高 b.同温同压下,复合催化剂有利于提高氨的平衡产率 c.温度越高,复合催化剂活性一定越高 (5)某合成氨速率方程为:v=k·cα(N2)·cβ(H2)·cγ(NH3),根据表中数据,γ=_______;
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率 (6)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188g·mol-1,则M元素为_______(填元素符号);在该化合物中,M离子的价电子排布式为_______。 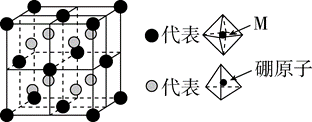 |
||||||||||||||||||||||||||
答案 |
(1)能 (2) ① 高 ② 低 (3)ab (4)a (5) ①-1 ②a (6) ①Fe ②3d6 |
||||||||||||||||||||||||||
| 题号 | 18 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | H2O2作为绿色氧化剂应用广泛,氢醌法制备H2O2原理及装置如下: 已知:H2O、HX等杂质易使Ni催化剂中毒。回答下列问题: (1)A中反应的离子方程式为___________。 (2)装置B应为___________(填序号)。 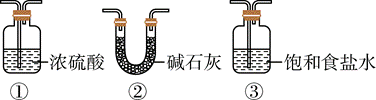 (3)检查装置气密性并加入药品,所有活塞处于关闭状态。开始制备时,打开活塞___________,控温45℃。一段时间后,仅保持活塞b打开,抽出残留气体。随后关闭活塞b,打开活塞___________,继续反应一段时间。关闭电源和活塞,过滤三颈烧瓶中混合物,加水萃取,分液,减压蒸馏,得产品。 (4)装置F的作用为___________。 (5)反应过程中,控温45℃的原因为___________。 (6)氢醌法制备H2O2总反应的化学方程式为___________。 (7)取2.50g产品,加蒸馏水定容至100mL摇匀,取20.00mL于锥形瓶中,用0.0500mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98mL、20.90mL、20.02mL。假设其他杂质不干扰结果,产品中H2O2质量分数为___________。 |
|||
答案 |
(1)Zn+2H+=Zn2++H2↑ (2)②或③① (3) ①a、c ②c、d (4)防止外界水蒸气进入C中使催化剂中毒 (5)适当升温加快反应速率,同时防止温度过高H2O2分解 (6) 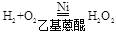 (7)17% |
|||
| 题号 | 19 |
|
||
出处 |
2022辽宁高考 | |||
| 题干 | 某药物成分H具有抗炎、抗病毒、抗氧化等生物活性,其合成路线如下: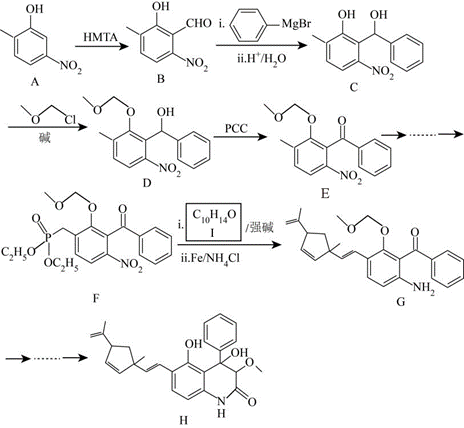 已知: 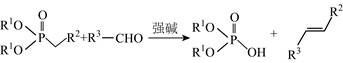 回答下列问题: (1)A的分子式为___________。 (2)在NaOH溶液中,苯酚与CH3OCH3Cl反应的化学方程式为___________。 (3)D→E中对应碳原子杂化方式由___________变为___________,PCC的作用为___________。 (4)F→G中步骤ⅱ实现了由___________到___________的转化(填官能团名称)。 (5)I的结构简式为___________。 (6)化合物I的同分异构体满足以下条件的有___________种(不考虑立体异构); i.含苯环且苯环上只有一个取代基 ii.红外光谱无醚键吸收峰 其中,苯环侧链上有3种不同化学环境的氢原子,且个数比为6∶2∶1的结构简式为___________(任写一种)。 |
|||
答案 |
(1)C7H7NO3 (2)  +CH3OCH2Cl+NaOH +CH3OCH2Cl+NaOH 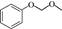 +NaCl+H2O +NaCl+H2O (3) ①sp3 ②sp2 ③. 选择性将分子中的羟基氧化为羰基 (4) ①硝基 ② 氨基 (5) 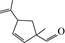 (6) ①12 ② (6) ①12 ②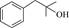 (或 (或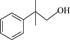 ) ) |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |