 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2023年普通高等学校招生全国统一考试(新课卷) | |
|---|---|
| 本卷共有试题:11 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 化学在文物的研究和修复中有重要作用。下列说法错误的是 A.竹简的成分之一纤维素属于天然高分子 B.龟甲的成分之一羟基磷灰石属于无机物 C.古陶瓷修复所用的熟石膏,其成分为Ca(OH)2 D.古壁画颜料中所用的铁红,其成分为Fe2O3 |
|||
答案 |
C | |||
| 题号 | 2 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 光学性能优良的高分子材料聚碳酸异山梨醇酯可由如下反应制备。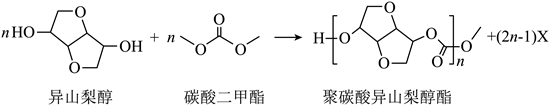 下列说法错误的是 A.该高分子材料可降解 B.异山梨醇分子中有3个手性碳 C.反应式中化合物X为甲醇 D.该聚合反应为缩聚反应 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如下图所示,其中[C(NH2)3]+为平面结构。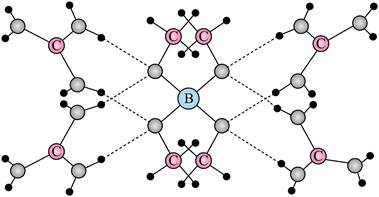 下列说法正确的是 A.该晶体中存在N-H…O氢键 B.基态原子的第一电离能:C<N<O C.基态原子未成对电子数:B<C<O<N D.晶体中B、N和O原子轨道的杂化类型相同 |
|||
答案 |
A | |||
| 题号 | 4 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 一种以V2O5和Zn为电极、Zn(CF3SO3)2水溶液为电解质的电池,其示意图如下所示。放电时,Zn2+可插入V2O5层间形成ZnxV2O5∙nH2O。下列说法错误的是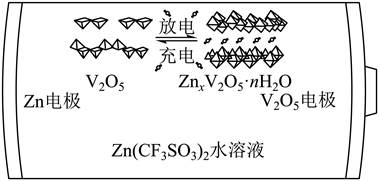 A.放电时V2O5为正极 B.放电时Zn2+由负极向正极迁移 C.充电总反应:xZn+V2O5+nH2O=ZnxV2O5∙nH2O D.充电阳极反应:ZnxV2O5∙nH2O-2xe-=xZn2++V2O5+nH2O |
|||
答案 |
C | |||
| 题号 | 5 |
|
|||||||||||||||
出处 |
2023全国新课标 | ||||||||||||||||
| 题干 | 根据实验操作及现象,下列结论中正确的是
|
||||||||||||||||
答案 |
C |
||||||||||||||||
| 题号 | 6 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | “肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如下所示。 下列说法错误的是 A.NH2OH、NH3和H2O均为极性分子 B.反应涉及N-H、N-O键断裂和N-N键生成 C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+ D.将NH2OH替换为NH2OD,反应可得ND2ND2 |
|||
答案 |
D |
|||
| 题号 | 7 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+,lg[c(M)/mol·L-1]与lg[c(NH3)/mol·L-1]的关系如下图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。 [Ag(NH3)2]+,lg[c(M)/mol·L-1]与lg[c(NH3)/mol·L-1]的关系如下图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。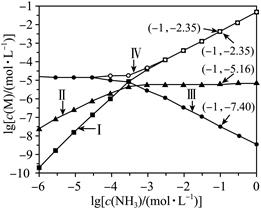 下列说法错误的是 A.曲线I可视为AgCl溶解度随NH3浓度变化曲线 B.AgCl的溶度积常数Ksp=c(Ag)∙c(Cl-)=10-9.75 C.反应[Ag(NH3)]++NH3  [Ag(NH3)2]+的平衡常数K的值为103.81 [Ag(NH3)2]+的平衡常数K的值为103.81D.c(NH3)=0.01mol·L-1时,溶液中c([Ag(NH3)2]+)>c()[Ag(NH3)]+ )>c(Ag+) |
|||
答案 |
A |
|||
| 题号 | 8 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示: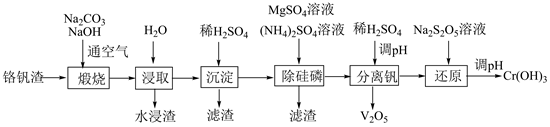 已知:最高价铬酸根在酸性介质中以Cr2O72-存在,在碱性介质中以CrO42-存在。 回答下列问题: (1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________(填化学式)。 (2)水浸渣中主要有SiO2和___________。 (3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________。 (4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________;pH>9时,会导致___________。 (5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO2+或VO3+在碱性条件下,溶解为VO3-或VO43-,上述性质说明V2O5具有___________(填标号)。 A.酸性 B.碱性 C.两性 (6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________。 |
|||
答案 |
(1)Na2CrO4 (2)Fe2O3 (3)Al(OH)3 (4)①.磷酸根会与H+反应使其浓度降低导致MgNH4PO4无法完全沉淀,同时可能产生硅酸胶状沉淀不宜处理 ②.会导镁离子生成氢氧化镁沉淀,不能形成MgSiO3沉淀,导致产品中混有杂质,同时溶液中铵根离子浓度降低导致MgNH4PO4无法完全沉淀 (5)C(6)2Cr2O72-+3S2O52-+10H+=4Cr3++6SO42-+5H2O |
|||
| 题号 | 9 |
|
||||||||||||||||||||
出处 |
2023全国新课标 | |||||||||||||||||||||
| 题干 | 实验室由安息香制备二苯乙二酮的反应式如下: 相关信息列表如下:
①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g FeCl3∙6H2O,边搅拌边加热,至固体全部溶解。 ②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。 ③加入50mL水,煮沸后冷却,有黄色固体析出。 ④过滤,并用冷水洗涤固体3次,得到粗品。 ⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。 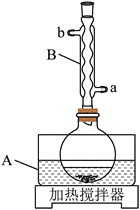 回答下列问题: (1)仪器A中应加入_______(填“水”或“油”)作为热传导介质。 (2)仪器B的名称是_______;冷却水应从_______(填“a”或“b”)口通入。 (3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_______。 (4)在本实验中,FeCl3为氧化剂且过量,其还原产物为_______;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行_______?简述判断理由_______。 (5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是_______。 (6)若粗品中混有少量未氧化的安息香,可用少量_______洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。 a.热水 b.乙酸 c.冷水 d.乙醇 (7)本实验的产率最接近于_______(填标号)。 a.80% b.80% c.75% d.70% |
|||||||||||||||||||||
答案 |
(1)油 (2) ①.球形冷凝管 ②.a (3)防暴沸 (4) ①.FeCl2 ②.可行 ③.空气可以将还原产物FeCl2又氧化为FeCl3,FeCl3可循环参与反应 (5)抑制氯化铁水解 (6)a (7)b |
|||||||||||||||||||||
| 题号 | 10 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题: (1)根据图1数据计算反应 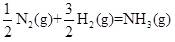 的ΔH= kJ·mol-1。 的ΔH= kJ·mol-1。 (2)研究表明,合成氨反应在Fe催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,N2*表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为_______(填步骤前的标号),理由是_______。 (3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287pm,密度为7.8g·cm-3,则α-Fe晶胞中含有Fe的原子数为_______(列出计算式,阿伏加德罗常数的值为NA)。 (4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为x(H2)=0.75、x(N2)=0.25,另一种为x(H2)=0.75、x(N2)=0.225、x(Ar)=0.10。(物质i的摩尔分数: 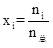 ) )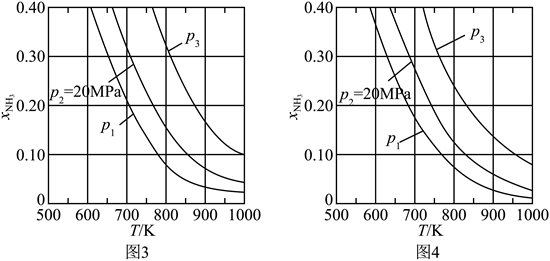 ①图中压强由小到大的顺序为_______,判断的依据是_______。 ②进料组成中含有惰性气体Ar的图是_______。 ③图3中,当p2=20MPa、x(NH3)=0.20时,氮气的转化率α=_______。该温度时,反应 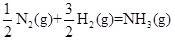 的平衡常数Kp=_______(MPa)-1(化为最简式)。 的平衡常数Kp=_______(MPa)-1(化为最简式)。 |
|||
答案 |
(1)-45 (2) ①.(ⅱ) ②.在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于N≡N的键能比H-H键的大很多,因此,在上述反应机理中,速率控制步骤为(ⅱ) (3) 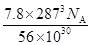 (4) ①.P1<P2<+3 ②.合成氨的反应为气体分子数减少的反应,压强越大平衡时氨的摩尔分数越大 ③.图4 ④.33.33% ⑤. 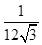 |
|||
| 题号 | 11 |
|
||
出处 |
2023全国新课标 | |||
| 题干 | 莫西赛利(化合物K)是一种治疗脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。以下为其合成路线之一。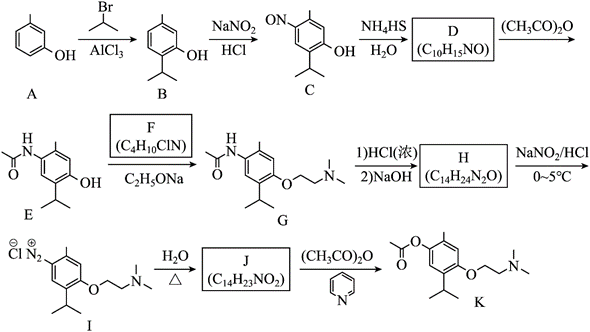 回答下列问题: (1)A的化学名称是_______。 (2)C中碳原子的轨道杂化类型有_______种。 (3)D中官能团的名称为_______、_______。 (4)E与F反应生成G的反应类型为_______。 (5)F的结构简式为_______。 (6)I转变为J的化学方程式为_______。 (7)在B的同分异构体中,同时满足下列条件的共有_______种(不考虑立体异构); ①含有手性碳;②含有三个甲基;③含有苯环。 其中,核磁共振氢谱显示为6组峰,且峰面积比为3:3:3:2:2:1的同分异构体的结构简式为_______。 |
|||
答案 |
(1)3-甲基苯酚(间甲基苯酚) (2)2 (3) ①.氨基 ②.羟基 (4)取代反应 (5) 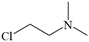 (6) 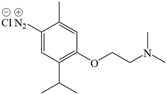 +H2O +H2O 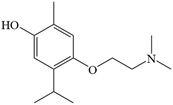 +HCl+N2↑ +HCl+N2↑ (7) ①.9 ②. 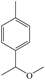 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |