 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 广州市2017届高三3月综合测试(一)化学试题 | |
|---|---|
| 本卷共有试题:12 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2017广州一 | |||
| 题干 | 化学与航空、航天密切相关,下列说法错误的是 A.镁用于制造轻合金,是制造飞机、火箭的重要材料 B.高纯度硅制成的光电池,可用作火星探测器的动力 C.聚酯纤维属于新型无机非金属材料,可制作宇航服 D.高温结构陶瓷耐高温、耐氧化,是喷气发动机的理想材料 |
|||
答案 |
C | |||
| 题号 | 2 |
|
||
出处 |
2017广州一 | |||
| 题干 | 下列关于有机化合物的说法正确的是 A.氯乙烯和溴乙烷均能发生加成反应 B.花生油和玉米油都是可皂化的饱和酯类 C.天然气和水煤气的主要成分都是烃类 D.分子式为C10H14的单取代芳烃,其可能的结构有4种 |
|||
答案 |
D | |||
| 题号 | 3 |
|
||
出处 |
2017广州一 | |||
| 题干 | 设NA为阿伏加德罗常数的值。下列有关叙述正确的是 A.23gNa与氧气充分燃烧,转移的电子数为NA B.1mol甲醇中含有的共价键数为4NA C.46gNO2和N2O4的混合气体含有的原子数为2NA D.标准状况下, 22.4L氨水含有NH3分子数为NA |
|||
答案 |
A | |||
| 题号 | 4 |
|
||
出处 |
2017广州一 | |||
| 题干 | 镍氢电池已经成为混合动力汽车的主要电池类型。该电池放电时的总反应为:NiOOH + MH==Ni(OH)2 + M,其中M表示储氢合金,MH表示吸附了氢原子的储氢合金,下列说法正确的是 A.放电时负极反应为:MH+OH--e-==M+H2O B.放电时,每转移1mol电子,有1mol NiOOH被氧化 C.充电时正极反应为:NiOOH+H2O+e-==Ni(OH)2+OH- D.电池电解液可用KOH溶液,充电过程中KOH浓度减小 |
|||
答案 |
A | |||
| 题号 | 5 |
|
||||||||||||||||||||
出处 |
2017广州一 | |||||||||||||||||||||
| 题干 | 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
 |
|||||||||||||||||||||
答案 |
C | |||||||||||||||||||||
| 题号 | 6 |
|
||
出处 |
2017广州一 | |||
| 题干 | 短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是 A.W与氢形成的原子比为1︰1的化合物有多种 B.X的氢化物只含有极性共价键 C.Y单质可通过电解Y的氯化物获得 D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
2017广州一 | |||
| 题干 | 25℃时,pH=2的HA和HB各1 mL分别加水稀释,pH随溶液体积变化如图所示。下列叙述正确的是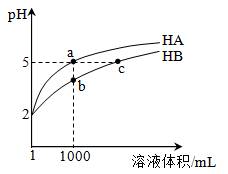 A.Kw的数值:a点大于c点 B.溶液中的总酸量:a点大于b点 C.HB的电离程度:b点大于c点 D.将a点与b点两溶液同时升高温度,则 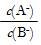 减小 减小 |
|||
答案 |
D | |||
| 题号 | 8 |
|
|||||||||||||||
出处 |
2017广州一 | ||||||||||||||||
| 题干 | “84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。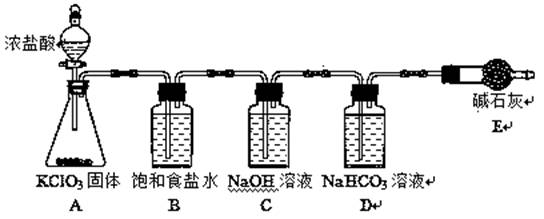 (1)该小组按上图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如下表。(已知饱和NaClO溶液pH为11)
②B瓶溶液中H+的主要来源是________。 ③C瓶溶液的溶质是________(填化学式)。 ④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因________。 (2)测定C瓶溶液中NaClO含量(单位:g·L-1)的实验步骤如下: Ⅰ.取C瓶溶液20 mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。 Ⅱ.用0.1000 mol·L-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00 mL Na2S2O3溶液。(I2+2S2O32-==2I-+S4O62-) ①步骤Ⅰ总反应的离子方程式为_______,盖紧瓶塞并在暗处反应的原因是________。 ②C瓶溶液中NaClO的含量为________g·L-1。(保留1位小数。NaClO式量为74.5) |
||||||||||||||||
答案 |
(1)KClO3+6HCl(浓) ==KCl+ 3Cl2↑+3H2O (2)氯气中混有的HCl (3)NaClO、NaCl、NaOH (4)溶液中存在平衡Cl2+H2O HCl+HClO,HCO3-消耗H+,使平衡右移,HClO的浓度增大。 (5)HClO+2I-+H+=I2+Cl-+H2O (6)防止HClO分解 (7)3.7 HCl+HClO,HCO3-消耗H+,使平衡右移,HClO的浓度增大。 (5)HClO+2I-+H+=I2+Cl-+H2O (6)防止HClO分解 (7)3.7 |
||||||||||||||||
| 题号 | 9 |
|
||
出处 |
2017广州一 | |||
| 题干 | 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。 Sabatier反应:CO2(g)+4H2(g)  CH4(g)+2H2O(g) CH4(g)+2H2O(g)水电解反应:2H2O(l)  2H2(g) + O2(g) 2H2(g) + O2(g)(1)将原料气按 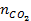 ∶ ∶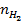 =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。 =1∶4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。①该反应的平衡常数K随温度升高而__________(填“增大”或“减小”)。 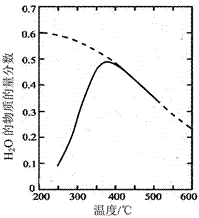 ②温度过高或过低均不利于该反应的进行,原因是________。 ③ 200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) (2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。 A.适当减压 B.增大催化剂的比表面积 C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例 E.合理控制反应器中气体的流速 (3)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)  C(s)+2H2O(g)代替Sabatier反应。 C(s)+2H2O(g)代替Sabatier反应。①已知CO2(g)、H2O(g)的生成焓分别为–394 kJ∙mol-1、–242 kJ∙mol-1,Bosch反应的ΔH =________kJ∙mol-1。(生成焓指一定条件下由对应单质生成1mol化合物时的反应热) ②一定条件下Bosch反应必须在高温下才能启动,原因是________。 ③新方案的优点是________。 |
|||
答案 |
(1)减小 (2)温度过低,反应速率减小 (3)温度过高,反应向右进行的程度小 (4)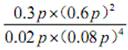 (5)BCE (6)-90 (7)反应的活化能高;氢原子利用率为100%。 (5)BCE (6)-90 (7)反应的活化能高;氢原子利用率为100%。 |
|||
| 题号 | 10 |
|
||
出处 |
2017广州一 | |||
| 题干 | 铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下: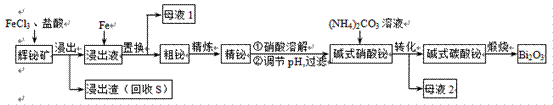 回答下列问题: (1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。 (2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为________,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。 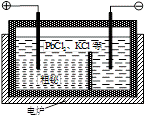 (3)“置换”时生成单质铋的离子方程式为________。“母液1”中通入气体X后可循环利用,气体X的化学式为________。 (4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极________;阴极________。 (5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。 |
|||
答案 |
(1) (2)6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S (3)Bi3++H2O+Cl-=BiOCl+2H+ (4)2Bi3++3Fe=3Fe2++2Bi (5)Cl2 (6)Pb-2e-=Pb2+ (7)Pb2++2e-=Pb (8)没有污染性气体产生 (9)NH4NO3 (2)6FeCl3+Bi2S3=2BiCl3+6FeCl2+3S (3)Bi3++H2O+Cl-=BiOCl+2H+ (4)2Bi3++3Fe=3Fe2++2Bi (5)Cl2 (6)Pb-2e-=Pb2+ (7)Pb2++2e-=Pb (8)没有污染性气体产生 (9)NH4NO3 |
|||
| 题号 | 11 |
|
||
出处 |
2017广州一 | |||
| 题干 | 硼及其化合物应用广泛。回答下列问题: (1)基态B原子的价电子轨道表达式为________,其第一电离能比Be ________(填“大”或“小”)。 (2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是________,写出一种与氨硼烷互为等电子体的分子________(填化学式)。 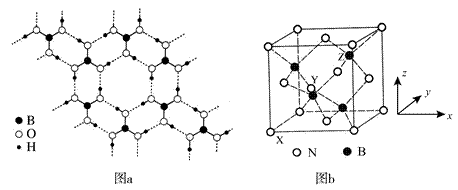 (3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图a。 ①B原子的杂化方式为________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:________。 ②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:________。 (4)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图b所示。 ①与氮原子直接连接的硼原子构成的几何形状为________。硼原子和氮原子所连接的最小环为________元环。 ②晶胞有两个基本要素: 原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。 晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d g∙cm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可) |
|||
答案 |
(1)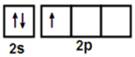 (2)小 (3)N (4)C2H6 (5)sp2 (6)硼酸分子间通过氢键缔合,加热时部分氢键被破坏。 (7).硼酸分子中B原子有一个2p空轨道。 (8).正四面体 (9).六 (10).( (2)小 (3)N (4)C2H6 (5)sp2 (6)硼酸分子间通过氢键缔合,加热时部分氢键被破坏。 (7).硼酸分子中B原子有一个2p空轨道。 (8).正四面体 (9).六 (10).( , , , , ) (11). ) (11).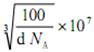 |
|||
| 题号 | 12 |
|
||
出处 |
2017广州一 | |||
| 题干 | 环丁基甲酸是重要的有机合成中间体,其一种合成路线如下: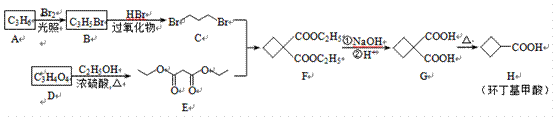 回答以下问题: (1)A属于烯烃,其结构简式为________。 (2)B→C的反应类型是________,该反应生成的与C互为同分异构体的副产物是________(写结构简式)。 (3)D的结构简式为________,E的化学名称是________。 (4)写出同时满足下列条件的G的所有同分异构体__________(写结构简式,不考虑立体异构)。 ①核磁共振氢谱为3组峰; ②能使溴的四氯化碳溶液褪色; ③1mol该同分异构体与足量饱和NaHCO3反应产生 88g气体。 (5)H的一种同分异构体为丙烯酸乙酯(CH2=CH—COOC2H5),写出聚丙烯酸乙酯在NaOH溶液中水解的化学方程式________。 (6)参照上述合成路线,以  和化合物E为原料(无机试剂任选),设计制备 和化合物E为原料(无机试剂任选),设计制备 的合成路线:________。 的合成路线:________。 |
|||
答案 |
(1)CH2=CH-CH3 (2)加成反应 (3)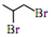 (4)HOOC-CH2-COOH (5)丙二酸二乙酯 (6)HOOC-CH2-CH=CH-CH2-COOH 、CH2=C(CH2-COOH)2 (7) (4)HOOC-CH2-COOH (5)丙二酸二乙酯 (6)HOOC-CH2-CH=CH-CH2-COOH 、CH2=C(CH2-COOH)2 (7)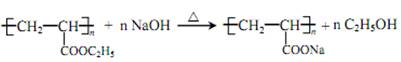 (8) (8)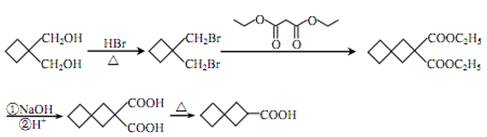 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |