题干 |
以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
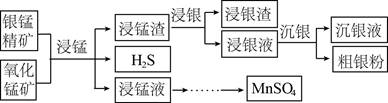
已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出:矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应MnS+2H+=Mn2++H2S↑,则可推断:Ksp(MnS) __________(填“>”或“<”)Ksp(Ag2S)。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有__________。
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
①将“浸银”反应的离子方程式补充完整:__________。
Fe3++Ag2S+  +2[AgCl2]-+S +2[AgCl2]-+S
②结合平衡移动原理,解释浸出剂中Cl-、H+的作用:____________________。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有______________________________。
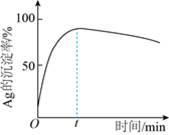
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:______________。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:________。
|
 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出