题干 |
硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)在N2气氛中,FeSO4∙7H2O的脱水热分解过程如图所示:

根据上述实验结果,可知x=_______,y=_______。
(2)已知下列热化学方程式:
FeSO4∙7H2O(s)=FeSO4 (s)+7 H2O(g) ΔH1=akJ·mol-1
FeSO4∙xH2O(s)=FeSO4 (s)+xH2O(g) ΔH2=bkJ·mol-1
FeSO4∙yH2O(s)=FeSO4 (s)+yH2O(g) ΔH2=ckJ·mol-1
则FeSO4∙7H2O(s) + FeSO4∙yH2O(s)=2(FeSO4∙xH2O) (s))的ΔH= kJ·mol-1
(3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:
FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时P(SO3)-T的关系如下图所示。600K时,该反应的平衡总压P(总)_______kPa、平衡常数Kp(I) Kp(I)=_______(kPa)2。Kp(I)随反应温度升高而_______(填“增大”“减小”或“不变”)。 Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时P(SO3)-T的关系如下图所示。600K时,该反应的平衡总压P(总)_______kPa、平衡常数Kp(I) Kp(I)=_______(kPa)2。Kp(I)随反应温度升高而_______(填“增大”“减小”或“不变”)。
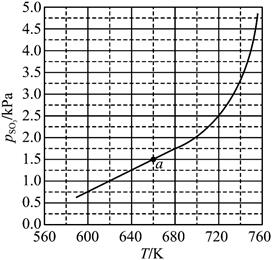
(4)提高温度,上述容器中进一步发生反应2SO3(g) 2SO2(g)+O2(g)(Ⅱ),平衡时P(O2)=_______(用P(SO3)、P(SO2)表示)。在929K时,P(总)=84.6kPa、P(SO3)=35.7kPa,则P(SO2)=_______kPa,Kp(II)=_______kPa(列出计算式)。 2SO2(g)+O2(g)(Ⅱ),平衡时P(O2)=_______(用P(SO3)、P(SO2)表示)。在929K时,P(总)=84.6kPa、P(SO3)=35.7kPa,则P(SO2)=_______kPa,Kp(II)=_______kPa(列出计算式)。
|
 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出