题干 |
过硫酸铵[(NH4)2S2O8]是一种重要的氧化剂、漂白剂。工业上用粗硫酸铵(杂质主要为含铁化合物)生产过硫酸铵,其工艺流程如下图所示。
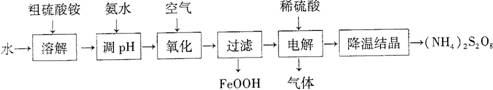
回答下列问题:
(1)0.1 mol•L-1 (NH4)2SO4溶液中,各种离子的浓度由大到小的顺序为 。
(2)“调pH”控制溶液的pH=10,室温下该溶液中c(NH4+):c(NH3•H2O)= 。
[已知:K(NH3•H2O) =1.7×10-5]
(3)“氧化”时有中间产物Fe6(OH)12SO4生成,该物质中n[Fe(Ⅱ)]:n[Fe(Ⅲ)]= ;该物质进一步被空气氧化成FeOOH的化学方程式为 。
[注:Fe(Ⅱ)表示二价铁,Fe(Ⅲ)表示三价铁]
(4)“电解”时,硫酸铵溶液的浓度为 400 g•L-1。1,其物质的量浓度是 mol•L-1。
(计算结果保留两位小数)
(5)“电解”装置如下图所示。
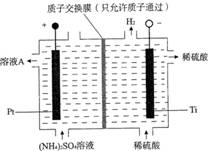
①阳极的电极反应式是 ;电解过程中阴极室溶液的pH (填“变大”“变小”或“不变”)。
②电解所得溶液A经降温结晶分离出NH4)2S2O8后,往剩余溶液中加入适量的硫酸铵和__ __(填化学式)后便可继续用作阳极室的电解液。
|
 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出