题干 |
二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。
(1)已知:CH4、CO、H2的燃烧热分别为890 kJ•mol-1、283 kJ•mol-1、285.8 kJ•mol-1,计算下列反应的反应热。CO2(g)+CH4(g)=2CO(g)+ 2H2(g)ΔH= kJ•mol-1。
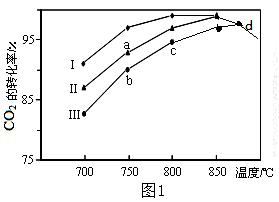
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2 CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。 CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①该反应的ΔH 0(填“>”或“<”)
②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是 。
 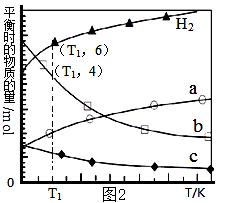
(3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示: C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①该反应在 自发进行(填“低温”或“高温”)。
②b代表的物质是 。
③T1温度下的平衡转化率为 ,相对于起始状态,平衡时气体的平均分子量增大的百分率为 (保留三位有效数字)。
|
 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出