 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 电解 | |
|---|---|
| 本卷共有试题:45 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2009福建质检 | |||
| 题干 | 将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池。已知。通人CH4的一极,其电极反应式是:CH4 + 10OH- - 8e-=CO32-+7 H2O;通入O2的另一极,其电极反应式是:2O2 + 4H2O + 8e- = 8OH-。下列叙述不正确的是 A.通人CH4的电极为负极 B.正极发生氧化反应 C.燃料电池工作时,溶液中的OH-向负极移动 D.该电池使用一段时间后应补充KOH |
|||
答案 |
B | |||
| 题号 | 2 |
|
||
出处 |
2009重庆高考 | |||
| 题干 | 化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。 (1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为 。 (2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 (3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。 ①Z与H2O2反应,其产物之一是Y的单质,Y的单质地电子式为 ;Z分子的结构呈 ②A的化学式是 (4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭河导弹上有重要应用),其反应的化学方程式是 |
|||
答案 |
(1) (2)Al3++4OH-=AlO2-+2H2O (3)①  ;三角锥形 ;三角锥形②AlN ④4Al+3tiO2+ 3C  Al2O3+3TiC Al2O3+3TiC |
|||
| 题号 | 3 |
|
||
出处 |
2009全国调研 | |||
| 题干 | 已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是 A.该装置中Cu极为正极 B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L C.b极反应的电极反应式为:H2-2e-=2H+ D.一段时间后锌片质量减少 |
|||
答案 |
B外电路中电子由铜流向a极,说明Cu为阳、Zn为阴极,a为正极、b为负极;b_极反应的电极反应式为:2H2一4e一十4OH-=4H2O;锌片的质量不变。 |
|||
| 题号 | 4 |
|
||
出处 |
2009云南统测 | |||
| 题干 | 观察下列几个装置示意图,有关叙述正确的是 A.装置①中阳极上析出红色固体 B.装置②的待镀铁制品应与电源正极相连 C.装置③中闭合电键后外电路电子由a极流向b极 D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 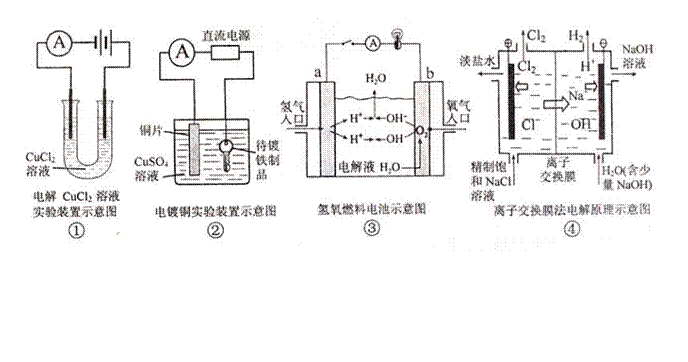 |
|||
答案 |
C | |||
| 题号 | 5 |
|
||
出处 |
2009山东诊断 | |||
| 题干 | 用酸性氢氧燃料电池电解苦卤水(含C1—、Br—、Na+、Mg2+)的装置如下图所示(a、b为石墨电极)。 下列说法中,正确的是 A.电池工作时,正极反应式为:O2+2H2O+4e—=4OH— B.电解时,a电极周围首先放电的是Br一而不是C1—说明当其它条件相同时前者的还原性强于后者 C.电解时,电子流动的路径是:负极→外电路→阴极→溶液→阳极→正极 D.忽略能量损耗,当电池中消耗 0.02gH2时,a极周围会产生0.71gCl2 |
|||
答案 |
B | |||
| 题号 | 6 |
|
||
出处 |
2009潍坊模拟 | |||
| 题干 | 下列说法正确的是 A.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起同样的保护作用 B.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大 C.稀硝酸、浓硫酸均能将木炭氧化成二氧化碳 D.工业上,半导体材料硅的应用非常广泛,其制备过程不涉及氧化还原反应 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
2006北京理综 | |||
| 题干 | 铝和氢氧化钾都是重要的工业产品。请回答: (1)工业冶炼铝的化学方程式是 。 (2)铝与氢氧化钾溶液反应的离子方程式是 。 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。 电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。  ①该电解槽的阳极反应式是 。 ②通电开始后,阴极附近溶液pH会增大,请简述原因 ③除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。 |
|||
答案 |
(1)2Al2O3  4Al+3O2↑ 4Al+3O2↑(2)2Al+2OH++2H2O=2AlO2-+3H2↑ (3)①4OH--4e-=2H2O+O2↑ ②H+放电,促进水的电离,OH-浓度增大 ③B |
|||
| 题号 | 8 |
|
||
出处 |
2008西城抽样 | |||
| 题干 | 右图为阳离子交换膜法电解饱和食盐水原理示意图。 下列说法不正确的是 A.从E口逸出的气体是H2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22.4 LCl2,便产生2 mol NaOH D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液 |
|||
答案 |
D | |||
| 题号 | 9 |
|
||
出处 |
2008全国I卷 | |||
| 题干 | 电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是 A.0.10mol/LAg+ B.0.02mol/L Zn2+ C.0.20mol/L Cu2+ D.0.20mol/L Pb2+ |
|||
答案 |
C | |||
| 题号 | 10 |
|
||
出处 |
2009南平质检 | |||
| 题干 | 右图中,两电极上发生的电极反应为:a极:Cu2++2e—=Cu b极:Fe—2e一=Fe2+,下列说法中不正确的是 A.该装置可能是电解池 B.a极上发生的是还原反应 C.a、b可能是同种电极材料 D.该装置在工作时,溶液中的阳离子可能向b极移动  |
|||
答案 |
D | |||
| 题号 | 11 |
|
||
出处 |
2008泉州模拟 | |||
| 题干 | 按图a中装置进行实验,若图b的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是 A.c(Ag+) B.c(NO3-) C.溶液的pH D.银棒质量  |
|||
答案 |
D | |||
| 题号 | 12 |
|
||
出处 |
2009山东高考 | |||
| 题干 | Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀.其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。 a.NaOH b.Zn c.Fe d.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。 |
|||
答案 |
(1)Zn(或锌) 正极 (2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b (3)2H++2e-==H2↑ 87 |
|||
| 题号 | 13 |
|
||
出处 |
2009启东一研 | |||
| 题干 | 如图, X和Y均为电极石墨: (I)若电解液为滴有酚酞的饱和食盐水,电解反应的离子方程式为: ; 电解过程中 极(填阴或阳)附近会出现红色; (II)若电解液为500mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g。 (1)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,需加入一定量的 (填加入物质的化学式)。(假设电解前后溶液的体积不变) (2)请你推测原溶液中所含的酸根离子可能是 ;并设计实验验证你的推测,写出实验的操作步骤、现象和结论: 。 |
|||
答案 |
(I)2Cl—+ 2H2O == 2OH—+Cl2↑+H2↑,阴极 (II)(1)1; CuO或CuCO3 (仅答1种即可) (2)硫酸根离子,取少量待测液于试管中,滴加盐酸无明显现象,继续加入氯化钡溶液若有白色沉淀产生,则证明硫酸根离子。 [或:硝酸根离子,取少量待测液于试管中,加热浓缩后滴加浓硫酸和铜粉若有红棕色气体产生,则证明硝酸根离子] |
|||
| 题号 | 14 |
|
||
出处 |
2009扬州调研 | |||
| 题干 | 电镀等工业废水中常含有剧毒、致癌的Cr2O72-。该废水处理的一种方法是:利用还原剂把Cr2O72-还原成毒性较低的Cr3+,再加碱生成沉淀。另一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解。下列说法错误的是: A.电解时,阳极反应为:Fe—2e-=Fe2+ B.电解过程中阴极能产生氢气 C.电解法中,转化Cr2O72-的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O D.电解过程中,阳极附近生成Fe(OH)3和Cr(OH)3沉淀 |
|||
答案 |
D | |||
| 题号 | 15 |
|
||
出处 |
2009安徽高考 | |||
| 题干 | Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2↑。下列说法正确的是 A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1mol电子转移时,有0.1molCu2O生成。  |
|||
答案 |
A | |||
| 题号 | 16 |
|
||
出处 |
2009广东会考 | |||
| 题干 | 用电镀法在铁制件表面镀上一层铜,下列做法正确的是 A.用铁制件做阳极 B.用铁制件做阴极 C.用Na2S04溶液做电镀液 D.用K2S04溶液做电镀液 |
|||
答案 |
B | |||
| 题号 | 17 |
|
||
出处 |
2007福州一检 | |||
| 题干 | 一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气。有关此电池的推断正确的是 A.负极反应为14H2O+7O2+28e—=28OH— B.放电一段时间后,负极周围的pH升高 C.每消耗1mol C2H6,则电路上转移的电子为14mol D.放电过程中KOH的物质的量浓度不变 |
|||
答案 |
C | |||
| 题号 | 18 |
|
||
出处 |
2008宁夏高考 | |||
| 题干 | 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。 该电池负极发生的反应是 A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e- B.O2(g)+4H+(aq)+4e_=2H2O(1) C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e- D.O2(g)+2H2O(1)+4e-=4OH- |
|||
答案 |
C | |||
| 题号 | 19 |
|
||
出处 |
2007天津联考一 | |||
| 题干 | 用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为 A.0.2mol B.0.4mol C.0.6mol D.0.8mol |
|||
答案 |
D | |||
| 题号 | 20 |
|
||
出处 |
2009海淀期末 | |||
| 题干 | 某温度时,用惰性电极电解硝酸钠的不饱和溶液。若两极板收集到气体总体积为22.4aL时,剩余溶液恢复至原温度,析出溶质mg;若两极收集到气体总体积为33.6aL时,剩余溶液恢复至原温度,析出溶质ng。则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积) A.  B. B. C.  D. D. |
|||
答案 |
C | |||
| 题号 | 21 |
|
||
出处 |
2008成都三诊 | |||
| 题干 | 化合物A、B、C、D、E分别由H+、Na+、Al3+、Cu2+四种阳离子和CO32-、Br-、SiO32-、SO42- 四种阴离子组成。 已知:①A、B、C三种溶液pH<7,D、E溶液pH>7 ②A、C的阴离子相同,D、E的阳离子相同 ③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成 ④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通如E的溶液中可产生另一种白色沉淀。 请根据以上事实填空: (1)写出B、C、E的化学式:B___________、C___________、E____________。 (2)D溶液的pH>7,原因是:_________________________________________。 (3)写出C溶液与D溶液发生反应的离子方程式:_______________________。 (4)若用石墨电极电解400mL,1.0 mo1·L—1A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________(设溶液的体积不变)。 |
|||
答案 |
(1)HBr Al2(SO4)3Na2SiO3 (2)因为CO32-能与水电离出的H+结合生成HCO3-,促进了水的电离,使溶液中的c(OH-)增大,所以溶液pH>7 (3)2Al3++CO32-+3H2O=2Al(OH)3↓+3H2O↑ (4)0 |
|||
| 题号 | 22 |
|
||
出处 |
2008上海高考 | |||
| 题干 | 取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圆呈浅红色。则下列说法错误的是 A.b电极是阴极 B.a电极与电源的正极相连接 C.电解过程中,水是氧化剂 D.b电极附近溶液的pH变小  |
|||
答案 |
D | |||
| 题号 | 23 |
|
||
出处 |
2007广州一研 | |||
| 题干 | 关于如图所示装置的叙述,正确的是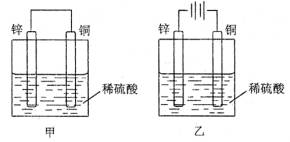 A.甲乙装置中锌片都作负极 B.甲乙装置中,溶液内的氢离子在铜片表面被还原 C.甲乙装置中,锌片上发生的反应都是还原反应 D.甲装置中,铜上面有气泡生成,乙装置中铜片质量减少 |
|||
答案 |
D | |||
| 题号 | 24 |
|
||
出处 |
2004全国Ⅲ卷 | |||
| 题干 |  在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答: (1)阳极上的电极反应式为_____________________。 (2)阴极上的电极反应式为_____________________。 (3)原上层液体是_____________________________。 (4)原下层液体是______________________________。 (5)搅拌后两层液体颜色发生变化的原因是________ 。 (6)要检验上层液体中含有的金属离子,其方法是_____________________________, 现象是_____________________________________________________________ _____________________________________________________________________。 |
|||
答案 |
(1)2I--2e-=I2
(2)2H++2e-=H2↑ (3)KI(或NaI等)水溶液 (4)CCl4(或CHCl3等) (5)I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中 (6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色(其它合理答案同样给分。例如,若③中答NaI水溶液,这里答火焰呈黄色。) |
|||
| 题号 | 25 |
|
||
出处 |
2005泉州模拟 | |||
| 题干 | 某学生用X、Y两装置(如下图)进行铜的电解精炼实验(粗铜中有锌、铁、镍银等杂质),下列说法正确的是 A、a应与c相连接,b应与d相连接 B、电解一段时间,b与d两极析出物质的物质的量相等 C、电解一段时间,b极附近溶液的pH降低 D、电解过程中,Y装置中Cu2+的浓度始终不变  |
|||
答案 |
B | |||
| 题号 | 26 |
|
||
出处 |
2005天星押题 | |||
| 题干 | 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是 A.右边电极上生成物质的质量:①=② B.两极上产生气体的体积:①<② C.溶液的pH变化:①增大,②减小 D.电极反应式①中阳极:4OH-+-4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |
|||
答案 |
B | |||
| 题号 | 27 |
|
||
出处 |
未知 | |||
| 题干 | 下列关于实验现象的描述不正确的是 A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 B、用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌 C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
|||
答案 |
C | |||
| 题号 | 28 |
|
||
出处 |
未知 | |||
| 题干 | 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是 A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近  |
|||
答案 |
B | |||
| 题号 | 29 |
|
||
出处 |
未知 | |||
| 题干 | 有甲、乙、丙、丁四种金属,将甲、乙用导线相连放入稀硫酸中可以看到乙慢慢溶解,而甲的表面有气泡逸出;把丁放到乙的硝酸盐溶液中后,丁表面覆盖一层乙的单质;用石墨电极电解含有相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出;将甲放入稀盐酸中有H2析出,已知四种金属中有一种是铜,根据以上实验判断,铜是 A.甲 B.乙 C.丙 D.丁 |
|||
答案 |
C | |||
| 题号 | 30 |
|
||
出处 |
2005江西九校 | |||
| 题干 | 图两个装置中,溶液体积均为200ml,开始时,电解质溶液的浓度均为0.1mol·L-1,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,则下列叙述正确的是  A.产生气体体积:①=② B.电极上析出固体质量:①<② C.电极反应式:①中阳极:4OH――4e-=2H2O+O2↑ ②中负极:2H++2e-=2H2↑ D.溶液的pH变化:①减小;②增大 |
|||
答案 |
D | |||
| 题号 | 31 |
|
||
出处 |
2006绵阳一诊 | |||
| 题干 | 如下图装置中,b电极用金属.M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答: (1)a为 极,c极的电极反应式为 。 (2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是: ,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为 . (3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了 moL气体,若b电极上沉积金属M的质量为0.432g,,则此金属的摩尔质量为 。 (4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到 25.0mL0.100mol·L—1HCI溶液中,当加入31.25mL溶液时刚好沉淀完全。试计算:电解前A烧杯中MNO3溶液的物质的量浓度。 |
|||
答案 |
(1)阳;2I—一2e—=I2 (2)c极附近的溶液首先变为蓝色 40H——4e—=2H2O+O2↑ (3)0.001;108g/mol (4)0.1mol·L—1 |
|||
| 题号 | 32 |
|
||
出处 |
2009泉州质检 | |||
| 题干 | 以惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。 回答下列问题: (1)甲在元素周期表中位置是 ; (2)若电解的是NaCl溶液: ①A与B反应的离子方程式是 ②若电解100mL0.1mol•L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化) (3)若电解的是CuSO4溶液: ①E的化学式是 ;电解时阳极的电极反应式是 ; ②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 。  A B C ③若利用反应A+B+C—→CuSO4+H2O,把化学能转化为电能,所设计电池的负极材料是 (填元素符号)。 |
|||
答案 |
(1)第3周期第ⅢA族 (2)①Cl2+2OH-= Cl-+ClO-+H2O;②13 (3)①SO2;4OH--4e-=O2↑+H2O ) ②A ③Cu |
|||
| 题号 | 33 |
|
||
出处 |
2007杭州一检 | |||
| 题干 | 如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转,说明此时该装置形成了原电池,关于该原电池的叙述正确的是 A. C(I)的电极名称是阴极 B.C(II)的电极名称是负极 C.C(I)的电极反应式是2H++2e—=H2↑ D.C(II)的电极反应式是Cl2+2e-=2Cl-  |
|||
答案 |
D | |||
| 题号 | 34 |
|
||
出处 |
2002广东高考 | |||
| 题干 | 在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是 A.原电池的正极和电解池的阳极所发生的反应 B.原电池的正极和电解池的阴极所发生的反应 C.原电池的负极和电解池的阳极所发生的反应 D.原电池的负极和电解池的阴极所发生的反应 |
|||
答案 |
BC | |||
| 题号 | 35 |
|
||
出处 |
2007成都一诊 | |||
| 题干 | 如右图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是 A.断开K2,闭合K1时,a极上的电极反应式为:4OH-一4e- === O2↑十+2H2O B.断开K2,闭合K1一段时间,溶液的pH要变大 C.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-=== H2↑ D.断开K1,闭合K2时,OH-向b极移动  |
|||
答案 |
C | |||
| 题号 | 36 |
|
||
出处 |
2008泉州质检 | |||
| 题干 | 右图中,两电极上发生的电极反应为: a极:Cu2++2e-=Cu b极:Fe-2e-=Fe2+ 下列说法不正确的是 A.装置中电解质溶液一定含有Cu2+ B.该装置一定是化学能转化为电能 C.a、b可能是同种电极材料 D.a极上一定发生还原反应  |
|||
答案 |
B | |||
| 题号 | 37 |
|
||
出处 |
2009福建质检 | |||
| 题干 | 短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白: (1)A单质与B单质发生反应的产物有 。(填化学式) (2)B、C组成的一种化合物与水发生化合反应的化学方程式为: (3)如右图所示,取一张用CD溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,b电极处的pH试纸上可观察到的现象是 , a电极的电极反应式为 。  (4)常温下,相同体积的0.2mol·L—1CD溶液与0.1mol·L—1 C2AB3溶液中,阳离子数目较多的是 溶液。(填化学式) |
|||
答案 |
(1)CO、CO2 (2)Na2O + H2O ==2NaOH (3)试纸先变红,随后红色区域扩大,后被漂白褪色;2H+ +2e- =H2↑(2H2O + 2e- =H2↑+ 2OH- (4)NaCl |
|||
| 题号 | 38 |
|
||
出处 |
2009海淀 | |||
| 题干 | 某课外活动小组同学用右图装置进行实验,试回答下列问题。 (1)若开始时开关K与a连接,则B极的电极反应式为 。 (2)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 。 有关上述实验,下列说法正确的是(填序号) 。 ①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24L气体,则溶液中转移0.2 mol电子 (3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图9装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。  ①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)一通过阳离子交换膜的离子数。 ②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。 ③通电开始后,阴极附近溶液pH会增大,请简述原因 。 ④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。 |
|||
答案 |
(1)Fe-2e = Fe2+ (2)2H+ + 2e- = H2↑ 2Cl- + 2H2O 电解 2OH- + H2↑ + Cl2↑ ② (3)① 4OH- - 4e- = 2H2O + O2↑, < ② D ③ H+放电,促进水的电离,OH-浓度增大 ④ O2 + 2H2O + 4e- = 4OH- |
|||
| 题号 | 39 |
|
||
出处 |
2009海淀期中 | |||
| 题干 | 某课外活动小组进行电解饱和食盐水的实验(如图)。  请回答下列问题: (1)通电一段时间后,可观察到 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为 。 (2)该溶液电解反应的化学方程式为 。 (3)若开始时改用铁棒做阳极,阳极的电极反应式为 。 (4)若用H2和O2为反应物,以KOH为电解质溶液, 可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入气体由孔隙中逸出,并在电极表面放电。其中a是 极(填“正”或“负”)。B极的电极反应式为 。  |
|||
答案 |
(1)阴极 2H++2e-=H2↑
(2)2NaC1+2H2O  C12↑+H2↑+2N aOH(2分) C12↑+H2↑+2N aOH(2分)(3)Fe-2e-Fe2+ (4)负 O2+2H2O+4e-=4OH- |
|||
| 题号 | 40 |
|
||
出处 |
2008成都三诊 | |||
| 题干 | 右图中,两电极上发生的电极反应如下:a极:2H++2e—=H2↑,b极:Zn—2e=Zn2+。则以下说法不正确的是 A.该装置可能是电解池 B.该装置中电解质溶液pH可能等于7 C.a、b可能是同种电极材料 D.该过程中能量的转换一定是化学能转化为电能  |
|||
答案 |
D | |||
| 题号 | 41 |
|
||
出处 |
2009潍坊一模 | |||
| 题干 | 下列说法正确的是 A.在原电池工作时,溶液中的阳离子向负极移动 B.用惰性电极电解某溶液,若两极分别只有H2和O2生成电解一段时间后,该溶液的浓度可能减小 C.要使电解后的CuSO4溶液复原,可向其中加入Cu(OH)2固体 D.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀 |
|||
答案 |
D | |||
| 题号 | 42 |
|
||
出处 |
2009福建高考 | |||
| 题干 | 控制适合的条件,将反应2Fe3++2I-  2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上Fe3+被还原 C.电流计读数为零时,反应达到化学平衡状态 D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极  |
|||
答案 |
D | |||
| 题号 | 43 |
|
||
出处 |
2007成都摸底 | |||
| 题干 | 根据右图所提供的信息,在反应一段时间后: (1)甲池中的现象为: 。 (2)甲池中总反应的离子方程式为 。 (3)乙池中总反应的离子方程式为 。 (4)将湿润的淀粉KI试纸放在乙池碳棒附近,发现试纸变蓝,其原因是(用离子方程式表示) ;但过一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2又氧化。若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为: 。 (5)若乙池的电源连接方向开始时就与上述的图示相反,则反应一段时间后,其溶液中可能出现的现象是 。  |
|||
答案 |
(1)铁棒逐渐溶解,碳棒上有红色物质析出,蓝色溶液逐渐变浅 (2)Fe+Cu2+====Fe2++Cu (3)2Cl-+2H2O  Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-(4)Cl2+2I-====I2+2Cl- 5Cl2+I2+6H2O====2HIO3 +10HCl (5)产生白色絮状沉淀 |
|||
| 题号 | 44 |
|
||
出处 |
未知 | |||
| 题干 | 置换反应的通式可表示为: 请回答下列问题: (1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为 。 (2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3  Al2O3+2Fe。 Al2O3+2Fe。除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 。 (3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。 (4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为 。 |
|||
答案 |
(1)2I- + Cl2 = I2 + 2Cl- (2)NaOH溶液 (3)SiO2 + 2C  Si + 2CO↑ Si + 2CO↑(4)2Mg+CO2  2MgO+C 2MgO+C |
|||
| 题号 | 45 |
|
||
出处 |
2009宁夏高考 | |||
| 题干 | 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。) (1)A、B、C、D代表的物质分别为___、___、___、___(填化学式); (2)反应①中的C、D均过量,该反应的化学方程式是____________; (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是__、__(填化学式); (4)反应③产物中K的化学式为_____________; (5)反应④的离子方程式为_____________。 |
|||
答案 |
(1)Al C H2O Na2O2 (2)2Na2O2+2H2O=4NaOH+O2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (3)CO2 CO (4)Na2CO3 (5)CO2+AlO2—+OH—+H2O=CO32-+Al(OH)3↓ |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |