 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 高二化学《电离平衡单元检测》(2) | |
|---|---|
| 本卷共有试题:26 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
未知 | |||
| 题干 | 常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是 A.1×10-14 B.1×10-13. C.1.32×10-14 D.1.32×10-15. |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
未知 | |||
| 题干 | 90℃时水的离子积KW=3.8×10-13,该温度时纯水的pH A.等于7 B.介于6~7之间. C.大于7 D.无法确定 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
未知 | |||
| 题干 | 能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 A.向水中投入一小块金属钠 . B.将水加热煮沸. C.向水中通入二氧化碳气体. D.向水中加食盐晶体 |
|||
答案 |
C | |||
| 题号 | 4 |
|
||
出处 |
未知 | |||
| 题干 | 下列酸溶液的pH相同时,其物质的量浓度最小的是 A.H2SO3 B.H2SO4. C.CH3COOH D.HNO3. |
|||
答案 |
B | |||
| 题号 | 5 |
|
||
出处 |
未知 | |||
| 题干 | 常温下c(OH-)最小的是 A.pH=0的溶液. B.0.05 mol·L-1 H2SO4. C.0.5 mol·L-1 HCl. D.0.05 mol·L-1的Ba(OH)2 |
|||
答案 |
B | |||
| 题号 | 6 |
|
||
出处 |
未知 | |||
| 题干 | 用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是 A.溶液中的c(CH3COO-) B.溶液中的c(H+) C.溶液中的c(CH3COOH) D.溶液中的c(OH-) |
|||
答案 |
D | |||
| 题号 | 7 |
|
||
出处 |
未知 | |||
| 题干 | 25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是 A.1×10-7mol·L-1 B.1×10-12mol·L-1. C.1×10-2mol·L-1 D.1×10-14mol·L-1. |
|||
答案 |
B | |||
| 题号 | 8 |
|
||
出处 |
未知 | |||
| 题干 | pH和体积都相同的醋酸和硫酸,分别与足量的Na2CO3溶液反应,在相同条件下放出二氧化碳气体的体积是 A.一样多 B.醋酸比硫酸多. C.硫酸比醋酸多 D.无法比较 |
|||
答案 |
B | |||
| 题号 | 9 |
|
||
出处 |
未知 | |||
| 题干 | 95℃时,水中的H+的物质的量浓度为10-6 mol·L-1,若把0.01 mol的NaOH固体溶解于95℃水中配成1 L溶液,则溶液的pH为 A.4 B.10 C.2 D.12 |
|||
答案 |
B | |||
| 题号 | 10 |
|
||
出处 |
未知 | |||
| 题干 | 将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的 A.pH=9 B.c(OH-)≈10-5mol·L-1 C.pH≈7 D.c(OH-)≈10-7 mol·L-1. |
|||
答案 |
CD | |||
| 题号 | 11 |
|
||
出处 |
未知 | |||
| 题干 | 体积相同,pH也相同的HCl、HNO3、CH3COOH分别与足量的NaHCO3反应,产生CO2的体积 A.同样多 B.HCl最多. C.HCl、HNO3一样多 D.CH3COOH最多. |
|||
答案 |
CD | |||
| 题号 | 12 |
|
||
出处 |
未知 | |||
| 题干 | 把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则两种溶液的体积比应是 A.10∶1 B.1∶10 C.1∶100 D.1∶2. |
|||
答案 |
B | |||
| 题号 | 13 |
|
||
出处 |
未知 | |||
| 题干 | 常温时,下列溶液的pH等于8或大于8的是 A.0.1 mol·L-1的NaOH溶液滴定稀盐酸,用酚酞做指示剂滴定到终点 B.pH=6的醋酸用水稀释100倍 C.pH=10的氢氧化钠溶液稀释1000倍 D.0.1 mol·L-1的硫酸100 mL跟0.2 mol·L-1 NaOH溶液150 mL完全反应 |
|||
答案 |
AD | |||
| 题号 | 14 |
|
||
出处 |
未知 | |||
| 题干 | 下列说法中正确的是 A.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基本相等. B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸分别与足量的锌反应,两者放出氢气的速率和质量均相等. C.100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等. D.100 mL 0.1 mol·L-1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的2倍. |
|||
答案 |
AD | |||
| 题号 | 15 |
|
||
出处 |
未知 | |||
| 题干 | 某酸溶液的pH=1,此酸溶液的物质的量浓度 A.0.1 mol·L-1. B.一定大于0.1 mol·L-1. C.若为强酸一定等于0.1 mol·L-1,若为弱酸一定大于0.1 mol·L-1. D.若为强酸一定≤0.1 mol·L-1,若为弱酸一定>0.1 mol·L-1. |
|||
答案 |
D | |||
| 题号 | 16 |
|
||
出处 |
未知 | |||
| 题干 | 某温度下,重水D2O的离子积为1.6×10-15,若用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是 A.中性溶液的pD=7.0. B.含0.01 mol的NaOD的D2O溶液1L,其pD=12.0. C.溶解0.01 mol的DCl的D2O溶液1L,其pD=2.0. D.在100 mL 0.25 mol·L-1的DCl重水溶液中,加入50 mL 0.2mol·L-1的NaOD的重水溶液,其pD=1.0. |
|||
答案 |
CD | |||
| 题号 | 17 |
|
||
出处 |
未知 | |||
| 题干 | 有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH-])。下列表述正确的是 A.在25℃时,若溶液呈中性,则pH=7,AG=1 B.在25℃时,若溶液呈酸性,则pH<7,AG<0 C.在25℃时,岩溶液呈碱性,则pH>7,AG>0 D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) |
|||
答案 |
D | |||
| 题号 | 18 |
|
||
出处 |
未知 | |||
| 题干 | pH=9 的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为(单位:mol·L-1) A. 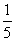 ×(4×10-9+1×10-12) B. ×(4×10-9+1×10-12) B. 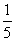 ×(8×10-9+1×10-12) ×(8×10-9+1×10-12) C.5×10-10 D.5×10-12 |
|||
答案 |
D | |||
| 题号 | 19 |
|
||
出处 |
未知 | |||
| 题干 | 某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为 A.V(酸)=102V(碱) B.V(碱)=102V(酸) C.V(酸)=2V(碱) D.V(碱)=2V(酸) |
|||
答案 |
B | |||
| 题号 | 20 |
|
||
出处 |
未知 | |||
| 题干 | 在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.01mol/L的醋酸溶液相比较,下列数值前者大于后者的是 A.中和时所需NaOH的量 B.电离度 C.对的物质的量 D.CH3COOH的物质的量 |
|||
答案 |
BC | |||
| 题号 | 21 |
|
||
出处 |
未知 | |||
| 题干 | 将pH= l的盐酸平均分成 2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为 A. 9 B.10 C.11 D.12 |
|||
答案 |
C | |||
| 题号 | 22 |
|
||
出处 |
未知 | |||
| 题干 | 在95℃时,纯水的pH (填“大于”“小于”“等于”)7,所选择的理由是 。 |
|||
答案 |
小于;250C时纯水的pH = 7,当升高温度时,水的电离程度增大,c(H+)也增大,故pH减小 |
|||
| 题号 | 23 |
|
||
出处 |
未知 | |||
| 题干 | 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答: (1)“O”点导电能力为“0”的理由是_______________________。 (2)A、B、C三点pH值由大到小的顺序是_______________________。 (3)A、B、C三点电离度最大的是____________________。  |
|||
答案 |
⑴冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。 (2)C>A>B (3)C |
|||
| 题号 | 24 |
|
||
出处 |
未知 | |||
| 题干 | 在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbL NaOH溶液,问: (1)若a+b=14,则Va/Vb= . (2)若a+b=13,则Va/Vb= (3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”) (题中a≤b,b≥8)。. |
|||
答案 |
⑴1 ⑵ 1/10⑶10a + b – 14;> |
|||
| 题号 | 25 |
|
||
出处 |
未知 | |||
| 题干 | 有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。 (1)如果加入蒸馏水,就加入________ mL (2)如果加入pH = 10的NaOH溶液,应加入_________ mL (3)如果加入0.008 mol/L HCl溶液,应加入__________ mL |
|||
答案 |
⑴ 900 ⑵ 1000 ⑶ 100 |
|||
| 题号 | 26 |
|
||
出处 |
未知 | |||
| 题干 | 用实验确定某酸HA是弱电解质。两同学的方案是: 甲:①称取一定质量的HA配制0.1mol/L的溶液100mL; ②用PH试纸测出该溶液的PH值,即可证明HA是弱电解质。 乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制PH=1的两种酸溶液各100mL; ②分别取这两种溶液各10mL,加水稀释为100mL; ③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。 (1)在两个方案的第①步中,都要用到的定量仪器是_____________。 (2)甲方案中,说明HA是弱电解质的理由是测得溶液的PH_________1(选填>、<、=);乙方案中,说明HA是弱电解质的现象是_____________(多选扣分) (a)装HCl的试管中放出H2的速率快 (b)装HA溶液的试管的中放出H2的速率快 (c)两个试管中产生气体速率一样快 (3)请你评价:乙方案中难以实现之处和不妥之处________________________。 (4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。 |
|||
答案 |
(1)100mL溶量瓶(注:未标明规格的扣分) (2)>b(多选扣分) (3)配制pH=1的HA溶液难以实现,不妥之处在于加入的锌粒表面积难以做到相同 (4)配制NaA溶液,测其pH值>7即证明HA是弱电解质。 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |