 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2023年湖北省普通高中学业水平选择性考试 | |
|---|---|
| 本卷共有试题:19 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2023湖北 | |||
| 题干 | 2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是 A.液氮-液氢 B.液氧-液氢 C.液态NO2-肼 D.液氧-煤油 |
|||
答案 |
A |
|||
| 题号 | 2 |
|
||
出处 |
2023湖北 | |||
| 题干 | 下列化学事实不符合“事物的双方既相互对立又相互统一”的哲学观点的是 A.石灰乳中存在沉淀溶解平衡 B. 氯气与强碱反应时既是氧化剂又是还原剂 C.铜锌原电池工作时,正极和负极同时发生反应 D. Li、Na、K的金属性随其核外电子层数增多而增强 |
|||
答案 |
D |
|||
| 题号 | 3 |
|
||
出处 |
2023湖北 | |||
| 题干 | 工业制备高纯硅的主要过程如下: 石英砂 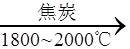 粗硅 粗硅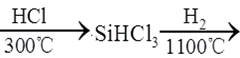 高纯硅 高纯硅下列说法错误的是 A.制备粗硅的反应方程式为SiO2+2C  Si+2CO↑ Si+2CO↑B. 1molSi含Si-Si键的数目约为4×6.02×1023 C.原料气HCl和H2应充分去除水和氧气 D.生成SiHCl3的反应为熵减过程 |
|||
答案 |
B |
|||
| 题号 | 4 |
|
||
出处 |
2023湖北 | |||
| 题干 | 湖北蕲春李时珍的《本草纲目》记载的中药丹参,其水溶性有效成分之一的结构简式如图。下列说法正确的是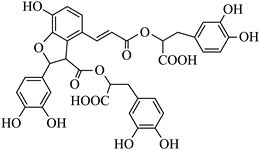 A.该物质属于芳香烃 B.可发生取代反应和氧化反应 C.分子中有5个手性碳原子 D. 1mol该物质最多消耗9molNaOH |
|||
答案 |
B | |||
| 题号 | 5 |
|
||
出处 |
2023湖北 | |||
| 题干 | 化学用语可以表达化学过程,下列化学用语的表达错误的是 A.用电子式表示K2S的形成: 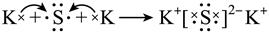 B.用离子方程式表示Al(OH)3溶于烧碱溶液:Al(OH)3+OH-=[Al(OH)4]- C.用电子云轮廓图表示H-H的s-sσ键形成的示意图: 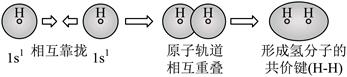 D.用化学方程式表示尿素与甲醛制备线型脲醛树脂: 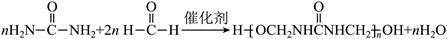 |
|||
答案 |
D |
|||
| 题号 | 6 |
|
||
出处 |
2023湖北 | |||
| 题干 | W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物(XY)+(WZ4)-。下列说法正确的是 A.分子的极性:WZ3<XZ3 B.第一电离能:X<Y<Z C.氧化性:X2Y3<W2Z3 D.键能:X2<Y2<Z2 |
|||
答案 |
A |
|||
| 题号 | 7 |
|
||
出处 |
2023湖北 | |||
| 题干 | 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是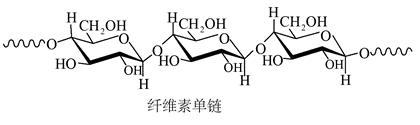 A.纤维素是自然界分布广泛的一种多糖 B.纤维素难溶于水的主要原因是其链间有多个氢键 C. NaOH提供OH-破坏纤维素链之间的氢键 D.低温降低了纤维素在NaOH溶液中的溶解性 |
|||
答案 |
D | |||
| 题号 | 8 |
|
||
出处 |
2023湖北 | |||
| 题干 | 实验室用以下装置(夹持和水浴加热装置略)制备乙酸异戊酯(沸点142℃),实验中利用环己烷-水的共沸体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),其反应原理: 下列说法错误的是 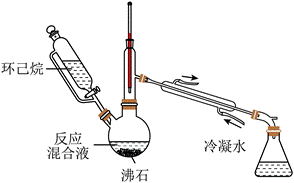 A.以共沸体系带水促使反应正向进行 B.反应时水浴温度需严格控制在69℃ C.接收瓶中会出现分层现象 D.根据带出水的体积可估算反应进度 |
|||
答案 |
B | |||
| 题号 | 9 |
|
||
出处 |
2023湖北 | |||
| 题干 | 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是 A. CH4和H2O的VSEPR模型均为四面体 B. SO32-和CO32-的空间构型均为平面三角形 C. CF4和SF4均为非极性分子 D. XeF2与XeO2的键角相等 |
|||
答案 |
A |
|||
| 题号 | 10 |
|
||
出处 |
2023湖北 | |||
| 题干 | 我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为xmol·h-1。下列说法错误的是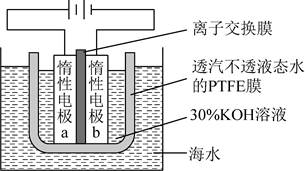 A. b电极反应式为2H2O+2e-=H2↑+2OH- B.离子交换膜为阴离子交换膜 C.电解时海水中动能高的水分子可穿过PTFE膜 D.海水为电解池补水的速率为2 xmol·h-1 |
|||
答案 |
D |
|||
| 题号 | 11 |
|
|||||||||||||||
出处 |
2023湖北 | ||||||||||||||||
| 题干 | 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
|
||||||||||||||||
答案 |
D |
||||||||||||||||
| 题号 | 12 |
|
||
出处 |
2023湖北 | |||
| 题干 | 下列事实不涉及烯醇式与酮式互变异构原理的是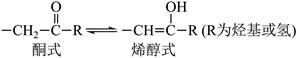 A. HC≡CH能与水反应生成CH3CHO B. 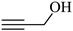 可与H2反应生成 可与H2反应生成 C. 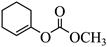 水解生成 水解生成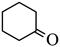 D. 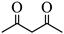 中存在具有分子内氢键的异构体 中存在具有分子内氢键的异构体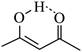 |
|||
答案 |
B |
|||
| 题号 | 13 |
|
||
出处 |
2023湖北 | |||
| 题干 | 利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下: 下列操作错误的是 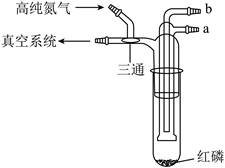 A.红磷使用前洗涤以除去表面杂质 B.将红磷转入装置,抽真空后加热外管以去除水和氧气 C.从a口通入冷凝水,升温使红磷转化 D.冷凝管外壁出现白磷,冷却后在氮气氛围下收集 |
|||
答案 |
C | |||
| 题号 | 14 |
|
||
出处 |
2023湖北 | |||
| 题干 | H2L为某邻苯二酚类配体,其pKa1=7.46,pKa2=12.4。常温下构建Fe(III)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4mol·L-1,c0(H2L)=5.0×10-3mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数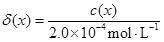 ,已知lg2≈0.30,lg3≈0.48。下列说法正确的是 ,已知lg2≈0.30,lg3≈0.48。下列说法正确的是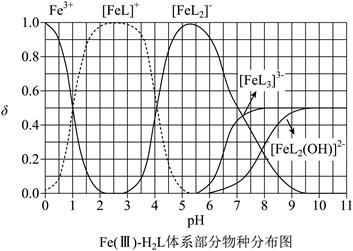 A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-) B. pH在9.5~10.5之间,含L的物种主要为L2- C. L2-+[FeL]+  [FeL2]-的平衡常数的lgK约为14 [FeL2]-的平衡常数的lgK约为14D.当pH=10时,参与配位的c(L2+)≈1.0×10-3mol·L-1 |
|||
答案 |
C |
|||
| 题号 | 15 |
|
||
出处 |
2023湖北 | |||
| 题干 | 镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是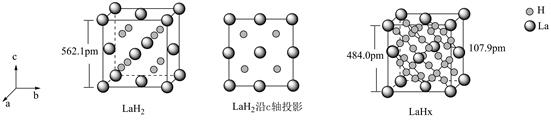 A. LaH2晶体中La的配位数为8 B.晶体中H和H的最短距离:LaH2>LaHx C.在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼 D. LaHx单位体积中含氢质量的计算式为 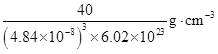 |
|||
答案 |
C |
|||
| 题号 | 16 |
|
||
出处 |
2023湖北 | |||
| 题干 | SiCl4是生产多晶硅的副产物。利用SiCl4对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属,工艺路线如下: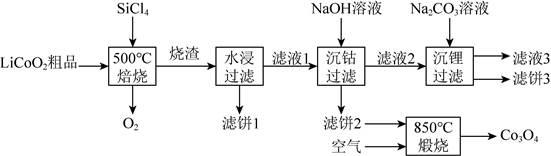 回答下列问题: (1)Co位于元素周期表第_______周期,第_______族。 (2)烧渣是LiCl、CoCl2和SiO2的混合物,“500℃焙烧”后剩余的SiCl4应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______。 (3)鉴别洗净的“滤饼3”和固体Na2CO3常用方法的名称是_______。 (4)已知Ksp[Co(OH)2]=5.9×10-15mol·L-1,若“沉钴过滤”的pH控制为10.0,则溶液中Co2+浓度为_______mol·L-1。“850℃煅烧”时的化学方程式为_______。 (5)导致SiCl4比CCl4易水解的因素有_______(填标号)。 a.Si-Cl键极性更大 b.Si的原子半径更大 c.Si-Cl键键能更大 d.Si有更多的价层轨道 |
|||
答案 |
(1) ①4 ②Ⅷ (2)SiCl4+3H2O=H2SiO3+4HCl (3)焰色反应 (4) ①5.9×10-7 ② 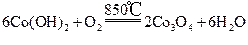 (5)abd |
|||
| 题号 | 17 |
|
||
出处 |
2023湖北 | |||
| 题干 | 碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料乙烯出发,针对二酮H设计了如下合成路线: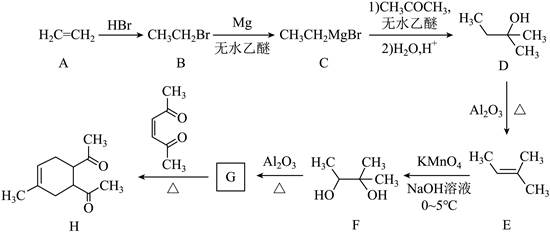 回答下列问题: (1)由A→B的反应中,乙烯的碳碳_______键断裂(填“π”或“σ”)。 (2)D的同分异构体中,与其具有相同官能团的有_______种(不考虑对映异构),其中核磁共振氢谱有三组峰,峰面积之比为9:2:1的结构简式为_______。 (3)E与足量酸性KMnO4溶液反应生成的有机物的名称为_______、_______。 (4)G的结构简式为_______。 (5)已知: 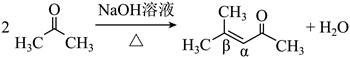 ,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I( ,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I(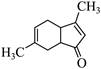 )和另一种α,β-不饱和酮J,J的结构简式为_______。若经此路线由H合成I,存在的问题有_______(填标号)。 )和另一种α,β-不饱和酮J,J的结构简式为_______。若经此路线由H合成I,存在的问题有_______(填标号)。a.原子利用率低 b.产物难以分离 c.反应条件苛刻 d.严重污染环境 |
|||
答案 |
(1)π (2)①7 ② 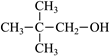 (3) ①乙酸 ②丙酮 (4)  (5)① 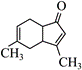 ②ab ②ab |
|||
| 题号 | 18 |
|
||
出处 |
2023湖北 | |||
| 题干 | 学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题: (1)铜与浓硝酸反应的装置如下图,仪器A的名称为_______,装置B的作用为_______。 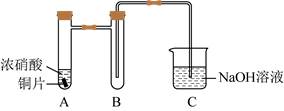 (2)铜与过量H2O2反应的探究如下: 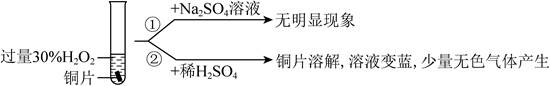 实验②中Cu溶解的离子方程式为_______;产生的气体为_______。比较实验①和②,从氧化还原角度说明H+的作用是_______。 (3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,mgX完全分解为ng黑色氧化物Y, 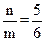 。X的化学式为_______。 。X的化学式为_______。(4)取含X粗品0.0500g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.1000mol·L-1Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液15.00mL。(已知:2Cu2++4I-=2CuI↓+I2,I2+ 2S2O32-=2I-+S4O62-)标志滴定终点的现象是_______,粗品中X的相对含量为_______。 |
|||
答案 |
(1)①具支试管 ②防倒吸 (2)①Cu+H2O2+2H+=Cu2++2H2O ②O2 ③既不是氧化剂,又不是还原剂,但可增强H2O2的氧化性 (3)CuO2 (4)①溶液蓝色消失,且半分钟不恢复原来的颜色 ②96% |
|||
| 题号 | 19 |
|
||
出处 |
2023湖北 | |||
| 题干 | 纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。C40H20(g)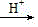 C40H18(g)+H2(g)的反应机理和能量变化如下: C40H18(g)+H2(g)的反应机理和能量变化如下: 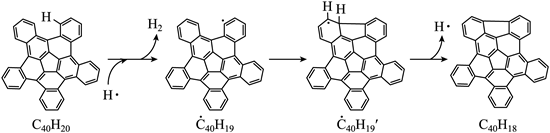 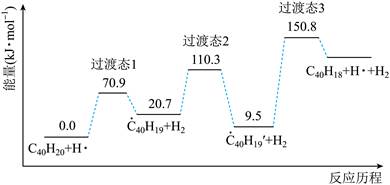 回答下列问题: (1)已知C40Hx中的碳氢键和碳碳键的键能分别为431.0kJ·mol-1和298.0kJ·mol-1,H-H键能为436.0kJ·mol-1。估算C40H20(g)=C40H18(g)+H2(g)的ΔH= kJ·mol-1。 (2)图示历程包含_______个基元反应,其中速率最慢的是第_______个。 (3)C40H10纳米碗中五元环和六元环结构的数目分别为_______、_______。 (4)1200K时,假定体系内只有反应C40H12(g)  C40H10(g)+H2(g)发生,反应过程中压强恒定为p0 (即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 C40H10(g)+H2(g)发生,反应过程中压强恒定为p0 (即C40H12的初始压强),平衡转化率为α,该反应的平衡常数Kp为_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(5)C40H19(g)  C40H18(g)+H·(g)及C40H11(g) C40H18(g)+H·(g)及C40H11(g) C40H10(g)+H·(g)反应的lnK (K为平衡常数)随温度倒数的关系如图所示。已知本实验条件下, C40H10(g)+H·(g)反应的lnK (K为平衡常数)随温度倒数的关系如图所示。已知本实验条件下,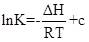 (R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是_______。 (R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是_______。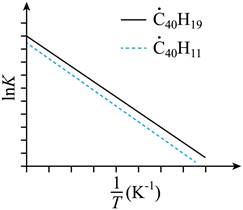 (6)下列措施既能提高反应物的平衡转化率,又能增大生成C40H10的反应速率的是_______(填标号)。 a.升高温度 b.增大压强 c.加入催化剂 |
|||
答案 |
(1)128 (2) ①3 ②3 (3) ①6 ②10 (4) 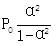 (5)在反应过程中,断裂和形成的化学键相同 (6)a |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |