 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2022年广州市普通高中毕业班综合测试(一) | |
|---|---|
| 本卷共有试题:21 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 中国空间站天和核心舱的主要能量来源是砷化镓(GaAs)太阳电池阵,其中Ga与Al同主族,化学性质相似。下列说法错误的是 A.砷化镓属于金属材料 B.GaAs中As的化合价是-3 C.镓既能与盐酸反应,又能与NaOH溶液反应 D.砷化镓电池能将光能转化为电能 |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 北京2022年冬奥会体现了绿色奥运、科技奥运。下列说法错误的是 A.飞扬火炬使用纯氢作燃料,实现碳排放为零 B.火炬燃料出口处有钠盐涂层,火焰呈明亮黄色 C.可降解餐具用聚乳酸制造,聚乳酸是天然高分子材料 D.速滑馆使用CO2制冰,比用氟利昂制冰更环保 |
|||
答案 |
C | |||
| 题号 | 3 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 绢本宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石[主要成分为Cu(OH)2·CuCO3],红色来自赭石(赤铁矿),黑色来自炭黑。下列说法错误的是 A.蚕丝制品绢的主要成分是蛋白质 B. 孔雀石受热易分解 C.赭石的主要成分是Fe3O4 D.炭黑由松枝烧制,该过程是化学变化 |
|||
答案 |
C | |||
| 题号 | 4 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 某学生设计了一种家用消毒液发生器,装置如图如示。下列说法错误的是 A.该消毒液的有效成分是NaClO B.通电时Cl-发生氧化反应 C.通电时电子从阳极经食盐溶液流向阴极 D. 该装置的优点是随制随用 |
|||
答案 |
C | |||
| 题号 | 5 |
|
|||||||||||||||
出处 |
2022广州一测 | ||||||||||||||||
| 题干 | 下列生活应用或生产活动,没有运用相应化学知识的是
|
||||||||||||||||
答案 |
A | ||||||||||||||||
| 题号 | 6 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 一种合成玫瑰香油的主要原料的结构简式如图所示,关于该有机物说法正确的是 A.分子式为C10H18O,属于烯烃 B.不能使酸性高锰酸钾溶液褪色 C.能发生水解反应 D.能发生加成反应和取代反应 |
|||
答案 |
D | |||
| 题号 | 7 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 溴甲基蓝(用HBb表示)指示剂是一元弱酸,HBb为黄色,Bb-为蓝色。下列叙述正确的是 A.0.01mol·L-1HBb溶液的pH=2 B.HBb溶液的pH随温度升高而减小 C.向NaOH溶液中滴加HBb指示剂,溶液显黄色 D.0.01mol·L-1NaBb溶液中,c(H+)+c(Na+)=c(Bb-)+c(HBb) |
|||
答案 |
B | |||
| 题号 | 8 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 部分含氮物质的分类与相应化合价关系如图所示。下列推断不合理的是 A. a既可被氧化,也可被还原 B. c溶于水可得d和b C.将铜丝插入d的浓溶液可产生b D.自然界可存在a→b→c→d→e的转化 |
|||
答案 |
C | |||
| 题号 | 9 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 设NA为阿伏加德罗常数的值,下列说法正确的是 A.32g甲醇中含有C-H键的数目为4NA B.1molFe溶于过量稀硝酸,转移的电子数目为3NA C.0.1mol·L-1HClO,溶液中含有阳离子总数为0.1NA D.标准状况下,22.4LN2和H2混合气中含有的原子数为4NA |
|||
答案 |
B | |||
| 题号 | 10 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述错误的是 A.可减少CO2的排放 B. Fe3O4和CaO均可循环利用 C.过程①和④的转化均为氧化还原反应 D.过程①的反应中有非极性键的断裂和生成 |
|||
答案 |
D | |||
| 题号 | 11 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 某化合物可用于制造激光器,其结构如图所示。已知元素X、Y、Z、W原子序数依次递增,且均不大于20,X与W同族,元素W的原子比Z原子多4个电子。下列说法正确的是 A.非金属性:Z>Y B.单质的沸点:Z>X>Y C.该化合物中Z满足8电子稳定结构 D.X、Y和W可形成既含有离子键又含有共价键的化合物 |
|||
答案 |
C | |||
| 题号 | 12 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 一定温度下向容器中加入A发生反应如下:①A→B,②A→C,③B⇌C。反应体系中A、B、C的浓度随时间t的变化曲线如图所示。下列说法错误的是 A.反应①的活化能大于反应② B. 该温度下,反应③的平衡常数大于1 C.t1时,B的消耗速率大于生成速率 D.t2时,c(C)=c0-c(B) |
|||
答案 |
A | |||
| 题号 | 13 |
|
|||||||||||||||
出处 |
2022广州一测 | ||||||||||||||||
| 题干 | 下列实验操作或实验方案,不能达到目的的是
|
||||||||||||||||
答案 |
D | ||||||||||||||||
| 题号 | 14 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 下列物质性质实验对应的离子方程式书写正确的是 A. Na2O2溶于水:Na2O2+H2O=2Na++2OH-+O2↑ B. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O C.同浓度同体积NH4HSO4溶液与NaOH溶液混合:NH4++OH-=NH3·H2O D. Na2S2O3溶液中通入足量氯气:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
|||
答案 |
D | |||
| 题号 | 15 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 我国科学家研发了一种室温下可充电的Na-CO2电池,示意图如下。放电时,Na2CO3与C均沉积在碳纳米管中,下列说法错误的是 A.充电时,阴极反应为:Na++e-=Na B.充电时,电源b极为正极,Na+向钠箔电极移动 C.放电时,转移0.4mol电子,碳纳米管电极增重21.2g D.放电时,电池的总反应为3CO2+4Na=2Na2CO3+C |
|||
答案 |
C | |||
| 题号 | 16 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 25℃时,用HCl和KOH固体改变0.1mol·L-1的邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3、Ka2=3.9×10-6)溶液的pH,lgc(H2A)、lgc(HA-)和Igc(A2-)随pH变化的关系如图所示。下列说法错误的是 A.曲线①代表lgc(H2A),曲线③代表lgc(A2-) B. P点时,c(K+)=c(H2A)+c(HA-)+c(A2-) C. 0.1mol·L-1KHA溶液中,c(K+)>c(HA-)>c(A2-)>c(H2A) D.用KOH固体改变KHA溶液pH至14过程中,c(A2-)一直增大 |
|||
答案 |
B | |||
| 题号 | 17 |
|
||||||||||||||||||||||||||||||||||||||||||||||||
出处 |
2022广州一测 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 题干 | 碘在科研与生活中有重要作用。 I.实验室按如下实验流程提取海带中的碘。 海带→灼烧→过滤→氧化→萃取、分流→I2的CCl4溶液 (1)上述实验流程中不需要用到的仪器是_______(从下列图中选择,写出名称)。 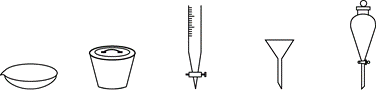 (2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为_______。 (3)海带灰中含有的其他可溶性无机盐。是在________(从以上流程中选填实验操作名称)中实现与碘分离。 II.定量探究S2O82-+2I-=2 SO42-+I2的反应速率与反应物浓度的关系。 查阅资料:该反应速率与c(S2O82-)和c(I-)的关系v=kcm(S2O82-)cn(I-),k为常数。 实验任务:测定不同浓度下的反应速率确定所m、n的值。 实验方法:按下表体积用量V将各溶液混合,(NH4)2S2O8溶液最后加入,记录开始反应至溶液出现蓝色所用的时间t。实验过程中发生如下反应:S2O82-+2I-=2 SO42-+I2(慢)I2+2 S2O32-=2I-+ S4O62-(快) 实验记录表:
(5)当溶液中_____(填化学式)耗尽后溶液出现蓝色。根据实验A的数据,反应速率v(S2O82--)=______mol·L-1·s-1(列出算式)。 (6)根据实验数据可确定m、n的值。n=1的判断依据是_____(用t的关系式来表示)。 |
|||||||||||||||||||||||||||||||||||||||||||||||||
答案 |
(1)蒸发皿 (2)H2O2+2I-+2H+=I2+2H2O (3)萃取分液 (4) ①.0 ②.7.5 ③.5 (5) ①.Na2S2O3 ②.  (6)t5=2 t4=4 t1 |
|||||||||||||||||||||||||||||||||||||||||||||||||
| 题号 | 18 |
|
|||||||||||||||
出处 |
2022广州一测 | ||||||||||||||||
| 题干 | 锑(Sb)不用作阻燃剂、电极材料、值化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如下: 已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为___________。 (2)“还原”时加入Sb的目的是将___________还原,提高产物的纯度。 (3)“水解”时需控制溶液pH=2.5。 ①Sb3+发生水解的离子方程式为___________。 ②下列能促进该水解反应的措施有___________(填字母)。 A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末 ③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于___________mol·L-1。 (4)“滤液”中含有的金属阳离子有___________。向“滤液”中通入足量___________(填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。将沉淀溶于浓盐酸后,产物可返回___________工序循环使用。 (5)Sb可由SbCl4-电解制得,阴极的电极反应式为___________。 |
||||||||||||||||
答案 |
(1)Sb2S3+6FeCl3=3S+2SbCl3+6FeCl2 (2)Fe3+ (3) ①.Sb3++Cl-+H2O=SbOCl+2H+ ②.ACD ③.10-2.9 (4) ①.Al3+、Fe2+、Mg2+ ②.Cl2 ③.溶浸 (5)SbCl4-+3e-=Sb+4Cl- |
||||||||||||||||
| 题号 | 19 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 以CO2、H2为原料合成CH3OH涉及的反应如下: I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49kJ·mol-1 II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41kJ·mol-1 III.CO(g)+2H2(g)⇌CH3OH(g) ΔH3 回答下列问题: (1)Kp为分压平衡常数,各反应的lnKp随1/T的变化如图所示。  计算反应III的ΔH3=___________kJ·mol-1,其对应的曲线为___________(填“a”或“c”) (2)在5MPa下,按照n(CO2):n(H2)=1:3投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图: 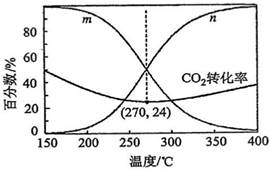 ①图中代表CH3OH的曲线为___________(填“m”或“n”)。 ②解释150~250℃范围内CO2转化率随温度升高而降低的原因___________。 ③下列说法错误的是___________(填字母)。 A.H2的平衡转化率始终低于CO2的 B.温度越低,越有利于工业生产CH3OH C.加入选择性高的催化剂,可提高CH3OH的平衡转化率 D.150-400℃范围内,温度升高,H2O的平衡产量先减小后增大 ④270℃时CO的分压为___________,反应II的平衡常数为___________(列出算式)。 |
|||
答案 |
(1) ①.-90 ②.a (2) ①.m ②.150~250℃范围内反应I逆向移动的程度大于反应II正向移动的程度 ③.ACD ④.0.15MPa ⑤.0.015 |
|||
| 题号 | 20 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。 回答下列问题: (1)基态铝原子的核外电子排布式为___________。 (2)基态氮原子的价层电子排布图为___________(填编号)。 A.  B. B.  C. C.  D. D.  (3)化合物I中碳原子的杂化轨道类型为___________,化合物II中阳离子的空间构型为___________。 (4)化合物III中O、F、S电负性由大到小的顺序为___________。 (5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________。 (6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。  ①晶体中与Al距离最近的Al的个数为___________。 ②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(  , , , , ),原子2的坐标为( ),原子2的坐标为( , , , , ),则原子3的坐标为_____。 ),则原子3的坐标为_____。③己知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______g·cm-3(列出计算式)。 |
|||
答案 |
(1)1s22s22p63s23p1 (2)C (3) ①.sp3杂化 ②.正四面体 (4)F>O>S (5)离子液体是由有机阳离子和无机阴离子组成,形成稳定的离子键 (6) ①.4 ②.(  , , , , ) ③. ) ③.  ×10-30 ×10-30 |
|||
| 题号 | 21 |
|
||
出处 |
2022广州一测 | |||
| 题干 | 化合物G是合成某强效镇痛药的关键中间体,其合成路线如下: 回答下列问题: (1)A的化学名称是___________。 (2)A生成B的方程式可表示为:A+I=B+Z+H2O,化合物Z的化学式为___________。 (3)D生成E的反应类型为___________。 (4)F生成G的离子反应方程式依次是:___________,___________。 (5)化合物B的芳香族同分异构体中,同时满足以下条件的有___________种。 条件:a.能够发生银镜反应; b.可与FeCl3溶液发生显色反应。 写出其中核磁共振氢谱在苯环上有两组峰,且峰面积为1:1的同分异构体的结构简式______。 (6)根据以上信息,写出以  及BrCH2COOC2H5为原料合成 及BrCH2COOC2H5为原料合成 的路线______(其他试剂任选)。 的路线______(其他试剂任选)。 |
|||
答案 |
(1)2-氯乙醛 (2)HCl (3)消去反应 (4)  (5) ①.13 ②.  (6)   |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |