 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2021~2022学年度 武汉市部分学校高三起点质量检测 | |
|---|---|
| 本卷共有试题:14 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 为相对原子质量的测定作出了卓越贡献的科学家是 A.屠呦呦 B.徐光宪 C.张青莲 D.侯德榜 |
|||
答案 |
C | |||
| 题号 | 2 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 合金种类繁多,应用广泛。下列不属于合金的是 A.黄金 B. 黄铜 C. 硬铝 D. 生铁 |
|||
答案 |
A | |||
| 题号 | 3 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 下列关于厨房用品有效成分的说法中,错误的是 A.食醋:乙酸 B. 白砂糖:葡萄糖 C.小苏打:碳酸氢钠 D. 花生油:高级脂肪酸甘油酯 |
|||
答案 |
B | |||
| 题号 | 4 |
|
||||||||
出处 |
2022武汉起点 | |||||||||
| 题干 | 离子检验的常用方法有三种:
A.NH4+:气体法 B.SO42-:气体法 C.Fe3+:显色法 D.Br-:沉淀法 |
|||||||||
答案 |
B | |||||||||
| 题号 | 5 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 理解实验原理、规范实验操作是实验成功的保障。下列说法正确的是 A.蒸发完成后,用坩埚钳把蒸发皿移至实验桌上冷却 B.加入萃取剂后,上下颠倒摇匀分液漏斗中的混合液 C.皂化反应完成后,加入饱和食盐水、分液除去甘油 D.利用焰色反应可以检测溶液中的钠离子、钾离子等 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 对储氢材料CaH2描述错误的是 A.离子半径:H->Li+ B.H-有强还原性 C.Ca2+最外层电子排布式:3s23p6 D.CaH2晶体中既有离子键又有共价键 |
|||
答案 |
D | |||
| 题号 | 7 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 某重金属解毒剂的分子结构如图所示,其中W、X、Y、Z均为短周期元素,且W、X、Y的质子数之和比Z的小1。下列说法错误的是 A.电负性:Y>Z>X>W B.该解毒剂的沸点比丙三醇的低 C.分子结构中X、Y、Z杂化类型相同 D.重金属提供孤电子对与该解毒剂形成配位键 |
|||
答案 |
D | |||
| 题号 | 8 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 尼泊金异丁酯可用作食品的保存剂、防霉剂,其结构简式如图所示。下列叙述错误的是 A.该有机物易溶于水 B.该有机物能够使酸性高锰酸钾溶液褪色 C. 1mol该有机物与足量浓溴水反应,最多消耗2mol Br2 D. 1mol该有机物与足量氢氧化钠溶液反应,最多消耗2molNaOH |
|||
答案 |
A | |||
| 题号 | 9 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 硬水结垢是循环冷却水系统中广泛存在的一种现象,西安交通大学徐浩团队改进了主动式电化学硬水处理技术,原理示意图如下(R代表有机物)。下列说法错误的是 A.处理后的水垢主要沉降在阴极附近 B.处理过程中Cl-可以循环利用 C.若将b电极换成铁电极,处理过程不受影响 D.若R为CO(NH2)2,消耗CO(NH2)2生成无污染的气体,则产生3mol H2 |
|||
答案 |
D | |||
| 题号 | 10 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 实验室模拟以碳酸氢铵和氯化钠为原料制备碳酸钠的过程如下: 下列说法错误的是 A.300℃加热所用仪器为坩埚 B.通过抽滤操作可快速达到固液分离的目的 C.晶体A是碳酸钠,30~35℃时碳酸钠的溶解度最小 D.可以先通足量氨气,再通过量CO2代替碳酸氢铵粉末 |
|||
答案 |
C | |||
| 题号 | 11 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 如图所示的酸碱溶液恰好完全中和,则下列叙述正确的是 A.实验②的混合溶液可能呈酸性 B.若V1>V2,则说明HA为强酸,HB为弱酸 C.因为两种酸溶液的pH相等,故V1一定等于V2 D.若实验①中,V= V1,则混合液中c(Na+)=c(A-) |
|||
答案 |
D |
|||
| 题号 | 12 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | “消洗灵”是一种广谱、高效、低毒的消毒洗涤剂,消毒原理与“84消毒液”相似,但更稳定,易保存。某“消洗灵”产品化学组成可以表示为Na10P3O13Cl•5H2O,实验室制备装置和过程如下: 回答下列问题: I.打开A中分液漏斗活塞,制备NaClO碱性溶液。 (1)A中盛装高锰酸钾的仪器名称是_______。 (2)X试剂的名称为_______。 (3)C中采用多孔球泡的目的是_______。 (4)D装置的作用是_______。 II.关闭A中分液漏斗活塞,打开C中分液漏斗活塞,一段时间后C中溶液经蒸发浓缩、冷却结晶、过滤得到粗产品 (5)产品中氯元素的化合价为_______。 (6)已知25℃时,Na2HPO4溶液的pH>7,原因是_______(用离子方程式表示)。 III.产品纯度测定(Na10P3O13Cl•5H2O的摩尔质量为M g/mol)。 ①取ag待测试样溶于蒸馏水配成250 mL溶液; ②取25.00mL待测液于锥形瓶中,加入10mL 2mol/L稀硫酸、25mL0.1mol/L碘化钾溶液(过量),此时溶液出现棕色; ③滴入3滴5%淀粉溶液,用0.05mol/L硫代硫酸钠溶液滴定至终点,平行滴定三次,平均消耗20.00mL。 已知:2S2O32-+I2=S4O62-+2I- (7)产品的纯度为_______(用含a、M的代数式表示)。 |
|||
答案 |
(1)圆底烧瓶 (2)饱和食盐水 (3)增大反应物的接触面积,加快反应速率 (4)吸收尾气,防止污染大气 (5)+1价 (6)HPO42-+H2O  H2PO4-+OH- H2PO4-+OH- (7)  |
|||
| 题号 | 13 |
|
||
出处 |
2022武汉起点 | |||
| 题干 | 有机物G是一种治疗尿失禁的新药,具有解痉和抗胆碱作用,其合成路线如下: 已知:  回答下列问题: (1)A的名称为_______。 (2)B→C反应中所需的试剂是_______。 (3)C→D的反应类型为_______。 (4)F的结构简式为_______。 (5)G中含氧官能团的名称为_______。 (6)D→E的反应方程式为_______。 (7)E有多种同分异构体,同时满足下列条件的同分异构体的共有17种,其中含有手性碳原子的物质的结构简式为_______。 ①分子中含有苯环; ②能与NaHCO3溶液反应产生气体; ③能发生银镜反应。 |
|||
答案 |
(1)乙苯 (2)NaOH乙醇溶液 (3)氧化反应 (4)  (5)羟基和酯基 (6)  +CH3OH +CH3OH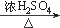  +H2O +H2O (7)  |
|||
| 题号 | 14 |
|
||||||||||||
出处 |
2022武汉起点 | |||||||||||||
| 题干 | 以含钛高炉渣(主要成分为TiO2,还含有少量CaO、CaO、Fe2O3、SiO2)为原料生产BaTiO3的工艺流程如下: 相关金属离子c(Mn+)=0.1mol/L时,形成氢氧化物沉淀的pH范围如下:
(2)“浸出液”中Ti以TiO2+形式存在,“酸浸”的主要反应离子方程式为_______。 (3)“浸出液”中加入Na2SO3的目的是_______。 (4)“调pH”的pH范围是_______。 (5)过滤得到BaTiO(C2O4)2•4H2O需要经过洗涤、减压烘干,检验沉淀是否洗净的方法是__。 (6)隔绝空气条件下,BaTiO(C2O4)2•4H2O在800℃灼烧得到BaTiO3,该反应的化学方程式为_______。 |
|||||||||||||
答案 |
(1)CaSO4 (2)TiO2+2H+=TiO2++H2O (3)还原Fe3+ (4)0.5~1.5 (5)向最后一次洗涤液中加入硝酸酸化,然后再加入硝酸银,若没有白色沉淀产生,则洗涤干净,反之,没有洗涤干净 (6) BaTiO(C2O4)2•4H2O  BaTiO3+2CO+2CO2+4H2O BaTiO3+2CO+2CO2+4H2O |
|||||||||||||
| v福建省实践教学工作室 蔡实践 设计制作 v |