 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 泉州市2021届高中毕业班质量监测(三) | |
|---|---|
| 本卷共有试题:15 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 化学与生产、生活、社会可持续发展密切相关。下列说法错误的是 A.漂白粉的有效成分为次氯酸钙 B.误食重金属离子可喝生牛奶解毒 C.SO2 可用作漂白剂和抗氧化剂 D.工业上常电解熔融MgO 冶炼Mg |
|||
答案 |
D | |||
| 题号 | 2 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 侯氏制碱主要反应为NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl。下列说法错误的是 A.CO2 的电子式:  B.Na+的结构示意图: B.Na+的结构示意图: C.上述反应的产物均为离子化合物 D.溶解度:NH4HCO3>NaHCO3 |
|||
答案 |
A | |||
| 题号 | 3 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 从松节油中提取的β-蒎烯可制取诺派酮、诺蒎酸等,反应原理如下: β-蒎烯 诺派酮 诺蒎酸 蒎二醇 下列说法正确的是 A.β-蒎烯的某种同分异构体可能是芳香烃 B.诺派酮分子中所有碳原子可能共平面 C.诺蒎酸与蒎二醇可用NaHCO3 溶液鉴别 D.以上四种有机物均易溶于水 |
|||
答案 |
C | |||
| 题号 | 4 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | NA 表示阿伏伽德罗常数的数值。下列说法正确的是 A.14.0 g 的N2 和CO 的混合气体中含有NA个原子 B.0.1 mol·L−1 NaHCO3 溶液中含有HCO 3-个数小于0.1NA C.0.5 mol N2 和1.5 mol H2 充分反应后,可得NH3 分子数为NA D.2.24 L 的Cl2 与NaOH 溶液完全反应,转移的电子数为0.2NA |
|||
答案 |
A | |||
| 题号 | 5 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | X、Y、Z、W 为原子序数依次增大的短周期元素,X 原子最外层电子数是其电子层数的2 倍, X、Y 的核电荷数之比为3∶4,金属单质Z 在空气中燃烧生成的化合物可与水发生氧化还原反应,W 的最高价氧化物的水化物具有两性。下列说法正确的是 A.最简单氢化物的稳定性:X>Y B.原子半径大小:W>Z>Y>X C.X、W 的最高价氧化物的水化物可发生反应 D.X、Y、Z 形成的化合物存在离子键和共价键 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||||||||||||||||||||
出处 |
2021泉州三检 | |||||||||||||||||||||
| 题干 | 下列实验操作、现象和结论都正确的是
|
|||||||||||||||||||||
答案 |
B | |||||||||||||||||||||
| 题号 | 7 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 实验室以磷石膏[主要成分为CaSO4,含少量SiO2、Ca3(PO4)2 等杂质]为原料制备轻质CaCO3,流程如下图。下列说法错误的是 A.“转化”中,包含反应CaSO4 +CO23-= SO24-+CaCO3 B.“滤液”的pH 约为6.5,阴离子主要是SO 24-和CO23- C.“高温煅烧”需要的仪器有酒精喷灯、坩埚、坩埚钳、泥三角、三脚架等 D.“浸取”时,适当升高温度有利于Ca2+的浸出 |
|||
答案 |
B | |||
| 题号 | 8 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 采用ZnBr2/SiO2 为催化剂,通过氧溴化可将甲烷转化为溴甲烷。该路线实现了甲烷的低温活化、有效抑制活泼产物的深度氧化,显著提高产物的选择性,其反应历程如图所示。下列说法错误的是 A.若用FeBr2 替换ZnBr2,溴甲烷的产率将降低 B.产物中可能混有CH2Br2 C.过程Ⅱ中氧化剂与还原剂的物质的量之比为2∶1 D.总反应为2CH4+2HBr+O2 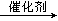 2CH3Br+2H2O 2CH3Br+2H2O
 |
|||
答案 |
C | |||
| 题号 | 9 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 双极膜(BP)是一种能将水分子解离成H+和OH-的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂[Fe2(OH)n(SO4)3-n/2]m(PFS)的电化学装置如图所示。下列说法错误的是 A.M 为阴离子交换膜,乙为OH- B.电极a 的电极反应式为2H+ +2e- = H2↑ C.电流密度过大,会使PFS 产品含量降低 D.若制得1 mol [Fe(OH)SO4]3,理论上转移的电子为2 mol |
|||
答案 |
D | |||
| 题号 | 10 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 向100 mL 5.0 mol·L−1 的NaOH 溶液中通入H2S 气体,含硫微粒在不同pH 溶液中的分布系数(δ)如图所示。下列说法正确的是A.曲线M 表示pH 与HS−的变化关系 B.S2−+H+  HS−的平衡常数数量级为1014 HS−的平衡常数数量级为1014C.HS−的电离程度大于水解程度 D.配制Na2S 溶液时可将Na2S 固体直接溶于水 |
|||
答案 |
B | |||
| 题号 | 11 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 研究从太阳能电池的碲化镉吸收层(主要含CdTe、CdS)中回收碲具有重要的意义。某回收工艺的流程如下: 回答下列问题: (1)FeOOH 中Fe 元素的化合价为 。 (2)反应釜中,溶液的pH、温度(T)与生成沉淀的关系如下图,图中区域分别表示铁的化合物稳定存在的区域。则制备FeOOH 适宜的pH 和温度分别为 (填标号)。  a.2,80℃ b.4,90℃ c.5,160℃ d.6,25℃ (3)制备磁性纳米铁棒时,加入NaBH4 前先通入N2 的作用是 。 (4)碲化镉吸收层中的CdTe 参与反应的化学方程式为 ,滤渣含有的一种单质是 。 (5)常温下,若在含Cd2+、Te4+滤液中加入NaOH 溶液调节pH 为7,溶液中c(Cd2+)的最大值为 。 (已知:Ksp[Cd(OH)2]=5.3×10−15) (6)从TeO32-溶液得到“吸附Te”,利用了纳米铁棒的性质有 、 。 |
|||
答案 |
(1)+3 (2)b (3)赶走空气(或氧气),防止NaBH4、纳米铁被氧气氧化 (4)CdTe+3H2O2+3H2SO4=CdSO4+Te(SO4)2+6H2O S (5)0.53mol·L−1 (6)还原性、吸附性(或磁性) 1 |
|||
| 题号 | 12 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 某兴趣小组设计实验探究SO2 与新制Cu(OH)2 悬浊液反应的产物。 按图连接好装置(夹持装置省略),打开磁搅拌器,先往20 mL1.00 mol·L−1 的CuCl2 溶液中加入20 mL 2.00 mol·L−1 的NaOH 溶液,再通入一定量SO2,三口烧瓶中生成大量白色沉淀X。回答下列问题: (1)以亚硫酸钠和浓硫酸为原料制取SO2,虚框中应选用 。(填“A”或“B”)装置,通入SO2 过程中不断搅拌的目的是 。  (2)仪器a 的名称为 ,烧杯中发生反应的离子方程式为 。 (3)据SO2 是酸性氧化物,推测X 可能为 。取少量X 加入稀硫酸进行验证,观察到 ,说明该推测错误。 (4)据SO2 的还原性,推测X 可能为CuCl,做如下验证实验。 ①取少量的X,加过量的氨水溶解,露置于空气中迅速得到深蓝色溶液,其中阳离子的化学式为 。 ②向深蓝色溶液中先加入过量的 ,再滴加 溶液,产生白色沉淀。 ③生成X 的离子方程式为 |
|||
答案 |
(1)B 增大接触面积,加快反应速率,使固体能充分反应 (2)干燥管 SO2+2OH—=SO32-+H2O (3)CuSO3 无气泡产生(或无明显现象等合理答案) (4)稀硝酸,AgNO3溶液 CuCl2Cu(OH)2 +SO2 +2Cl—=2CuCl+SO+2H2O |
|||
| 题号 | 13 |
|
||||||||
出处 |
2021泉州三检 | |||||||||
| 题干 | 研究甲醇的合成方法和用途具有重要的价值。 Ⅰ. 利用合成气(CO 和H2)合成甲醇,发生如下反应: CO(g)+2H2(g)  CH3OH(g) ΔH CH3OH(g) ΔH(1)由元素最稳定的单质生成1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔHf)。几种物质的标准摩尔生成焓如下表,则ΔH= kJ·mol−1。
(3)T ℃时,在密闭的刚性容器中,按物质的量之比1∶1 充入CO 和H2,若平衡时容器内总压为p Pa,H2 的转化率为50%。则T ℃时,上述反应的平衡常数Kp= Pa−2。 (用含p的代数式表示,Kp 为用分压表示的平衡常数)。 Ⅱ. 甲醇也可以通过微生物电催化反应合成,装置如右图所示。  (4)石墨电极上的电极反应式为,当体系的温度升高到一定程度,电极反应的速率反而迅速下降,主要原因是 。 Ⅲ. 甲醇催化脱水制二甲醚日益受到关注,反应方程式为: 2CH3OH(g) →CH3OCH3(g)+H2O(g) ΔH<0,某催化反应的机理如下: 历程i:CH3OH(g)→ CH3OH◎ 历程ⅱ:CH3OH◎+CH3OH◎ →CH3OCH3◎+H2O◎ 历程ⅲ:…… 历程iv:H2O◎  H2O(g) 上述历程中,“◎”代表分子吸附在催化剂表面上。 H2O(g) 上述历程中,“◎”代表分子吸附在催化剂表面上。(5)为提高CH3OH 的平衡转化率,可采用的措施是 。 A.容积不变,充入一定量He B.及时分离出H2O(g) C.进一步改进催化剂 D.降低反应温度 (6)历程ⅲ: 。 |
|||||||||
答案 |
(1)-90.64 (2)< (3)3/p2 (4)CO2+6H++6e—=CH3OH+H2O 温度过高,微生物失去催化活性 (5)BD (6)CH3OCH3◎ CH3OCH3(g) |
|||||||||
| 题号 | 14 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | LiBH4-MgH2-AlH3 是一种具有良好释氢性能的三元复合储氢材料。 回答下列问题: (1)下列说法正确的是 (填标号)。 A.该材料中,五种元素的基态原子都没有成对的p 电子 B.该材料中,五种元素的电负性最大的是H C.Li+已无电子可发生跃迁,故Li+灼烧时火焰为无色 D.MgH2 熔点高于AlH3,原因是Mg2+半径比Al3+小,与H-形成的化学键更强 (2)BH4-的空间构型为 ,其中B 原子的轨道杂化方式为 。 (3)LiBH4 晶体中含有的微粒间作用力有 (填标号)。 A.离子键 B.π键 C.氢键 D.配位键 (4)氢化镁(h-MgH2)是一种单层的二维材料,二维晶胞俯视图如图1。  ①h-MgH2中,M的配位数为 。 ②3×3×1 的h-MgH2 晶胞中,涂黑处的Mg 被Mn 替换,形成掺杂h-MgH2(晶胞如图2 所示,H 已省略)的化学式为 。 |
|||
答案 |
(1)B (2)正四面体 sp3杂化 (3)AD (4)①6 ②Mg8MnH18 |
|||
| 题号 | 15 |
|
||
出处 |
2021泉州三检 | |||
| 题干 | 依莰舒(E)是一种紫外线吸收剂,可以做成水溶性防晒化妆品。一种以樟脑(A)为起始原料合成依莰舒的路线如下图所示。 回答下列问题: (1)A 的官能团名称为 ,反应Ⅰ的化学方程式为 。 (2)Ⅲ的反应类型为 。 (3)有关C 和E 的说法正确的是 。 a.都能使酸性高锰酸钾溶液褪色 b.1 mol E 最多能与4 mol H2 发生加成反应 c.C 中含有6 个手性碳原子 d.溴的四氯化碳溶液可鉴别C 和E (4)反应Ⅱ为加成反应(不考虑酸碱中和),则X(C8H6O2)的结构简式为 。化合物Y 是X 的同分异构体,其核磁共振氢谱有4 组峰,峰面积比为1∶2∶2∶1。Y 遇FeCl3 溶液显紫色。Y 的结构简式为 (任写一种)。 |
|||
答案 |
(1)羰基 (2)消去反应 (3)  ad ad (4)  |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |