 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2021年广东省普通高中学业水平选择性考试化学试题(广东卷) | |
|---|---|
| 本卷共有试题:21 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
|||||||||||||||
出处 |
2021广东高考 | ||||||||||||||||
| 题干 | 今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是
|
||||||||||||||||
答案 |
A | ||||||||||||||||
| 题号 | 2 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是 A.广东剪纸的裁剪过程不涉及化学变化 B.冲泡工夫茶时茶香四溢,体现了分子是运动的 C.制作粤绣所用的植物纤维布含有天然高分子化合物 D.染整技艺中去除丝胶所用的纯碱水溶液属于纯净物 |
|||
答案 |
D | |||
| 题号 | 3 |
|
||
出处 |
2021广东高考 | |||
| 题干 | “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是 A.煤油是可再生能源 B.H2燃烧过程中热能转化为化学能 C.火星陨石中的20Ne质量数为20 D.月壤中的3He与地球上的3H互为同位素 |
|||
答案 |
C | |||
| 题号 | 4 |
|
|||||||||||||||
出处 |
2021广东高考 | ||||||||||||||||
| 题干 | 化学创造美好生活。下列生产活动中,没有运用相应化学原理的是
|
||||||||||||||||
答案 |
A | ||||||||||||||||
| 题号 | 5 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图所示,关于该化合物说法不正确的是 A.属于烷烃 B.可发生水解反应 C.可发生加聚反应 D.具有一定的挥发性 |
|||
答案 |
A | |||
| 题号 | 6 |
|
|||||||||||||||
出处 |
2021广东高考 | ||||||||||||||||
| 题干 | 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是
|
||||||||||||||||
答案 |
C | ||||||||||||||||
| 题号 | 7 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 测定浓硫酸试剂中H2SO4含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00 mL待测液,用0.1 mol/L的NaOH溶液滴定。上述操作中,不需要用到的仪器为 A.  B. B. C. C. D. D. |
|||
答案 |
B | |||
| 题号 | 8 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是 A.0.001 mol/L GHCl水溶液的pH=3 B.0.001 mol/L GHCl水溶液加水稀释,pH升高 C.GHCl在水中的电离方程式为:GHCl=G+HCl D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G) |
|||
答案 |
B | |||
| 题号 | 9 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时 A.负极上发生还原反应 B.CO2在正极上得电子 C.阳离子由正极移向负极 D.将电能转化为化学能 |
|||
答案 |
B | |||
| 题号 | 10 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是 A.a可与e反应生成b B.b既可被氧化,也可被还原 C.可将e加入浓碱液中制得d的胶体 D.可存在b→c→d→e→b的循环转化关系 |
|||
答案 |
C | |||
| 题号 | 11 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 设NA为阿伏加德罗常数的值。下列说法正确的是 A.1mol CHCl3含有C-Cl键的数目为3NA B.1L 1.0mol/L的盐酸含有阴离子总数为2NA C.11.2L NO与11.2 LO2混合后的分子数目为NA D.23g Na与足量H2O反应生成的H2分子数目为NA |
|||
答案 |
A | |||
| 题号 | 12 |
|
|||||||||||||||
出处 |
2021广东高考 | ||||||||||||||||
| 题干 | 化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是
|
||||||||||||||||
答案 |
B | ||||||||||||||||
| 题号 | 13 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是 A.XEZ4是一种强酸 B.非金属性:W>Z>Y C.原子半径:Y>W>E D.ZW2中,Z的化合价为+2价 |
|||
答案 |
C | |||
| 题号 | 14 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 反应X=2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是 A.a为c(X)随t的变化曲线 B.t1时,c(X)=c(Y)=c(Z) C.t2时,Y的消耗速率大于生成速率 D.t3后,c(Z)=2c0-c(Y) |
|||
答案 |
D | |||
| 题号 | 15 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是 A.Na2O2放入水中:Na2O2+H2O=2NaOH+O2↑ B.H2O(g)通过灼热铁粉:3H2O+2Fe=Fe2O3+3H2↑ C.铜丝插入热的浓硫酸中:Cu+H2SO4=CuSO4+H2↑ D.SO2通入酸性KMnO4溶液中:5SO2+2H2O+2MnO4-=5SO52-+4H++2Mn2+ |
|||
答案 |
D | |||
| 题号 | 16 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是 A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大 B.生成1mol Co,Ⅰ室溶液质量理论上减少16g C.移除两交换膜后,石墨电极上发生的反应不变 D.电解总反应:2Co2++2H2O  2Co+O2↑+4H+ 2Co+O2↑+4H+ |
|||
答案 |
D | |||
| 题号 | 17 |
|
||||||||||||||||||||||||||||
出处 |
2021广东高考 | |||||||||||||||||||||||||||||
| 题干 | 含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。 (1)实验室沿用舍勒的方法制取Cl2的化学方程式为_______。 (2)实验室制取干燥Cl2时,净化与收集Cl2所需装置的接口连接顺序为_______。  (3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______已分解。检验此久置氯水中Cl-存在的操作及现象是_______。 (4)某合作学习小组进行以下实验探究。 ①实验任务。通过测定溶液电导率,探究温度对AgCl溶解度的影响。 ②查阅资料。电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。25℃时,Ksp(AgCl)=1.8×10-10。 ③提出猜想。 猜想a:较高温度的AgCl饱和溶液的电导率较大。 猜想b:AgCl在水中的溶解度s(45℃)>s(35℃)>s(25℃)。 ④设计实验、验证猜想。取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表中实验1~3,记录数据。
实验结果为A3>A2>A1。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有_______。 ⑥优化实验。小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表中内容。
|
|||||||||||||||||||||||||||||
答案 |
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O(2)c-d-b-a-e (3)HClO;向溶液中加入过量稀硝酸,防止溶液中含有CO32-、HCO3-等,再加入少量AgNO3溶液,若有白色沉淀生成,则证明原溶液中含有Cl- (4)1.34×10-5 测试温度不同,根据电导率结果无法判断不同温度下饱和溶液的溶解度 45℃ II 45℃ A3>B2>B1 |
|||||||||||||||||||||||||||||
| 题号 | 18 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下: 已知:25℃时,H2CO3的Ka1=4.5×10-7,Ka2=4.7×10-11;Ksp(BaMoO4)=3.5×10-8;Ksp(BaCO3)=2.6×10-9;该工艺中,pH>6.0时,溶液中Mo元素以MoO42-的形态存在。 (1)“焙烧”中,有Na2MoO4生成,其中Mo元素的化合价为_______。 (2)“沉铝”中,生成的沉淀X为_______。 (3)“沉钼”中,pH为7.0。 ①生成BaMoO4的离子方程式为_______。 ②若条件控制不当,BaCO3也会沉淀。为避免BaMoO4中混入BaCO3沉淀,溶液中c(HCO3-):c(MoO42-)=_______(列出算式)时,应停止加入BaCL2溶液。 (4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为_______。 ②往滤液Ⅲ中添加适量NaCl固体后,通入足量_______(填化学式)气体,再通入足量CO2,可析出Y。 (5)高纯AlAs (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。  ①该氧化物为_______。 ②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为_______。 |
|||
答案 |
(1)+6 (2)Al(OH)3 (3) MoO42-+Ba2+=BaMoO4↓  (4)NaHCO3 NH3 (5)Al2O3 4:1 |
|||
| 题号 | 19 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应: a)CH4(g)+CO2(g)  2CO(g)+2H2(g) ∆H1 2CO(g)+2H2(g) ∆H1b)CO2(g)+H2(g)  CO(g)+H2O(g) ∆H2 CO(g)+H2O(g) ∆H2c)CH4(g)  C(s)+2H2(g) ∆H3 C(s)+2H2(g) ∆H3d)2CO(g)  CO2(g)+C(s) ∆H4 CO2(g)+C(s) ∆H4e)CO(g)+H2(g)  H2O(g)+C(s) ∆H5 H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=_______(写出一个代数式即可)。 (2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。 A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 B.移去部分C(s),反应c、d、e的平衡均向右移动 C.加入反应a的催化剂,可提高CH4的平衡转化率 D.降低反应温度,反应a~e的正、逆反应速率都减小 (3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_______步进行,其中,第_______步的正反应活化能最大。  (4)设Kpr为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln Kpr随1/T(温度的倒数)的变化如图所示。  ①反应a、c、e中,属于吸热反应的有_______(填字母)。 ②反应c的相对压力平衡常数表达式为Kpr=_______。 ③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程_______。 (5)CO2用途广泛,写出基于其物理性质的一种用途:_______。 |
|||
答案 |
(1)∆H2+∆H3-∆H5或∆H3-∆H4 (2)AD (3)4 4 (4) ①ac ②  ③68% ③68%(5)做冷冻剂 |
|||
| 题号 | 20 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。 (1)基态硫原子价电子排布式为__________。 (2)H2S、CH4、H2O的沸点由高到低顺序为__________。 (3)汞的原子序数为80,位于元素周期表第______周期第ⅡB族。 (4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。 A.在I中S原子采取sp3杂化B.在Ⅱ中S元素的电负性最大 C.在Ⅲ中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键 E. 在Ⅳ中硫氧键的键能均相等 (5)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是________。 (6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。  ①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是__________________。 ②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_________;该晶胞中粒子个数比Hg:Ge:Sb =_________。 ③设X的最简式的式量为Mr,则X晶体的密度为________g/cm3(列出算式)。 |
|||
答案 |
(1)3s23p4 (2)H2O>H2S>CH4 (3)六 (4)D (5)化合物III (6)①由图9c可知,图9b中Sb、Hg原子取代位置除图9b外还有其它形式 ②4;1:1:2 ③  |
|||
| 题号 | 21 |
|
||
出处 |
2021广东高考 | |||
| 题干 | 天然产物Ⅴ具有抗疟活性,某研究小组以化合物Ⅰ为原料合成Ⅴ及其衍生物Ⅵ的路线如下(部分反应条件省略,Ph表示-C6H5):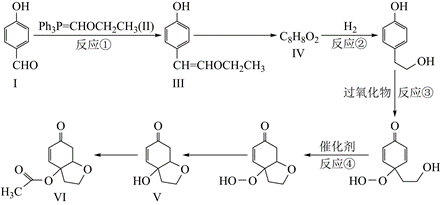 已知:  (1)化合物Ⅰ中含氧官能团有_______(写名称)。 (2)反应①的方程式可表示为:I+II=III+Z,化合物Z的分子式为_______。 (3)化合物IV能发生银镜反应,其结构简式为_______。 (4)反应②③④中属于还原反应的有_______,属于加成反应的有_______。 (5)化合物Ⅵ的芳香族同分异构体中,同时满足如下条件的有_______种,写出其中任意一种的结构简式:_______。 条件:a.能与NaHCO3反应;b. 最多能与2倍物质的量的NaOH反应;c. 能与3倍物质的量的Na发生放出H2的反应;d.核磁共振氢谱确定分子中有6个化学环境相同的氢原子;e.不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。 (6)根据上述信息,写出以苯酚的一种同系物及HOCH2CH2Cl为原料合成  的路线_______(不需注明反应条件)。 的路线_______(不需注明反应条件)。 |
|||
答案 |
(1)(酚)羟基、醛基 (2)C18H15OP (3)  (4)②④;② (5)10;  (6)  |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |