 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 化学平衡 | |
|---|---|
| 本卷共有试题:17 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2015海南高考 | |||
| 题干 | 10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是 A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3 |
|||
答案 |
AB | |||
| 题号 | 2 |
|
||
出处 |
2015上海高考 | |||
| 题干 | 对于合成氨反应,达到平衡后,以下分析正确的是 A.升高温度,对正反应的反应速率影响更大 B.增大压强,对正反应的反应速率影响更大 C.减小反应物浓度,对逆反应的反应速率影响更大 D.加入催化剂,对逆反应的反应速率影响更大 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
2015天津高考 | |||
| 题干 | 某温度下,在 2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是A.m=2 B.两次平衡的平衡常数相同 C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L‾1 |
|||
答案 |
D | |||
| 题号 | 4 |
|
||
出处 |
2010重庆高考 | |||
| 题干 | COCl2(g)  CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施①升温 ②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂 ⑥恒通入惰性气体,能提高COCl2转化率的是 CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施①升温 ②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂 ⑥恒通入惰性气体,能提高COCl2转化率的是A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥ |
|||
答案 |
B | |||
| 题号 | 5 |
|
||
出处 |
2008海南高考 | |||
| 题干 | X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于: 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于:A、33% B、40% C、50% D、65% |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2018江苏高考 | |||
| 题干 | 根据下列图示所得出的结论不正确的是 A.图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小 |
|||
答案 |
C | |||
| 题号 | 7 |
|
||
出处 |
2018江苏高考 | |||
| 题干 | 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下: 2SO3(g)(正反应放热),测得反应的相关数据如下: 下列说法正确的是 A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3 C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1 |
|||
答案 |
CD | |||
| 题号 | 8 |
|
||
出处 |
2017江苏高考 | |||
| 题干 | H2O2分解速率受多种因素影响。实验测得 70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是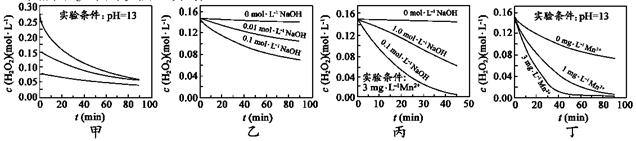 A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快 B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快 C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |
|||
答案 |
D | |||
| 题号 | 9 |
|
||
出处 |
2017天津高考 | |||
| 题干 | 常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) Ni(CO)4(g)。 230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。 Ni(CO)4(g)。 230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4; 第二阶段:将第一阶段反应后的气体分离出来,加热至 230℃制得高纯镍。 下列判断正确的是 A.增加c(CO),平衡向正向移动,反应的平衡常数增大 B.第一阶段,在 30℃和 50℃两者之间选择反应温度,选 50℃ C.第二阶段,Ni(CO)4分解率较低 D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
|||
答案 |
B | |||
| 题号 | 10 |
|
||
出处 |
2016江苏高考 | |||
| 题干 | 一定温度下,在3个体积均为 1.0 L的容量密闭容器中反应2H2(g)+CO(g) CH3OH(g)达到平衡,下列说法正确的是 CH3OH(g)达到平衡,下列说法正确的是 A.该方应的正反应放热 B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
|||
答案 |
AD | |||
| 题号 | 11 |
|
||
出处 |
2015重庆高考 | |||
| 题干 | 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1。 反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是 COS(g)+H2(g) K=0.1。 反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是A.升高温度,H2S浓度增加,表明该反应是吸热反应 B.通入CO后,正反应速率逐渐增大 C.反应前H2S物质的量为7mol D.CO的平衡转化率为80% |
|||
答案 |
C | |||
| 题号 | 12 |
|
||
出处 |
2012天津高考 | |||
| 题干 | 已知2SO2 (g) + O2 (g)  2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是 2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是A.容器内压强P:P甲=P丙> 2P乙 B.SO3的质量m:m甲=m丙> 2m乙 C.c(SO2)与c(O2)之比k:k甲=k丙> k乙 D.反应放出或吸收热量的数值Q:Q甲=G丙> 2Q乙 |
|||
答案 |
B | |||
| 题号 | 13 |
|
||
出处 |
2011重庆高考 | |||
| 题干 | 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是  温度(T)的影响 压强(p)的影响 A.CO2(g)+2NH3(g)  CO(NH2)2(s) + H2O(g);△H<0 CO(NH2)2(s) + H2O(g);△H<0B.CO2(g)+ H2(g)  CO(g) + H2O(g);△H>0 CO(g) + H2O(g);△H>0C.CH3CH2OH(g)  CH2=CH2(g) + H2O(g);△H>0 CH2=CH2(g) + H2O(g);△H>0D.2C6H5CH2CH3(g) + O2(g)  2C6H5CH=CH2(g) + 2 H2O(g);△H<0 2C6H5CH=CH2(g) + 2 H2O(g);△H<0 |
|||
答案 |
A | |||
| 题号 | 14 |
|
||||||||||||||||||||||||
出处 |
2010江苏高考 | |||||||||||||||||||||||||
| 题干 | 在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2=2NH3(g) ΔH=-92.4kJ/mol
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3<1 |
|||||||||||||||||||||||||
答案 |
BD | |||||||||||||||||||||||||
| 题号 | 15 |
|
||
出处 |
2017全国卷I | |||
| 题干 | 近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题: (1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_________(填标号)。 A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的导电能力低于相同浓度的亚硫酸 C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D.氢硫酸的还原性强于亚硫酸 (2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。  通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________。 (3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)  COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入 2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。 COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入 2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。①H2S的平衡转化率α1=_______%,反应平衡常数K=________。 ②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2_____α1,该反应的Δ H_____0。(填“>”“<”或“=”) ③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号) A. H2S B. CO2 C.COS D.N2 |
|||
答案 |
(1)D (2)H2O(l)=H2(g)+  O2(g) ΔH=286kJ•mol-1 O2(g) ΔH=286kJ•mol-1H2S(l)=H2(g)+S(s) ΔH=20kJ•mol-1 系统(II) (3)①2.5 2.8×10-5 ②> > ③B |
|||
| 题号 | 16 |
|
|||||||||||||||
出处 |
2018全国II卷 | ||||||||||||||||
| 题干 | CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。 已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1 C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1 C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1 该催化重整反应的Δ H==______kJ·mol−1。有利于提高CH4平衡转化率的条件是____(填标号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 某温度下,在体积为 2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。 (2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。 相关数据如下表:
 A.K积、K消均增加 B.v积减小,v消增加 C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大 ②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。  |
||||||||||||||||
答案 |
(1)247 (2)A (3)  (4)劣于 (5)相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 (6)AD (7) pc(CO2)、pb(CO2)、pa(CO2) |
||||||||||||||||
| 题号 | 17 |
|
||||||||||||||||||
出处 |
2018全国I卷 | |||||||||||||||||||
| 题干 | 采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题 (1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。 (2)F. Daniels等曾利用测压法在刚性反应器中研究了 25℃时N2O5(g)分解反应:  其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
2NO2(g)=N2O4(g) ΔH2=−55.3 kJ·mol−1 则反应N2O5(g)=2NO2(g)+  O2(g)的ΔH=_______ kJ·mol−1。 O2(g)的ΔH=_______ kJ·mol−1。②研究表明,N2O5(g)分解的反应速率  。t=62 min时,测得体系中pO2=2.9 kPa,则此时的 。t=62 min时,测得体系中pO2=2.9 kPa,则此时的 =________kPa,v=_______kPa·min−1。 =________kPa,v=_______kPa·min−1。③若提高反应温度至 35℃,则N2O5(g)完全分解后体系压强p∞( 35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。 ④ 25℃时N2O4(g)  2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程: 第一步 N2O5  NO2+NO3 快速平衡 NO2+NO3 快速平衡第二步 NO2+NO3→NO+NO2+O2 慢反应 第三步 NO+NO3→2NO2 快反应 其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。 A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3 C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高 |
|||||||||||||||||||
答案 |
(1)①O2 ②53.1 30.0 6.0×10-2 ③大于 温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 ④13.4 (8)AC |
|||||||||||||||||||
| v福建省实践教学工作室 蔡实践 设计制作 v |