 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 高二期末复习综合试卷(化学反应原理及有机物的合成) | |
|---|---|
| 本卷共有试题:35 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2016海南高考 | |||
| 题干 | 油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应: C37H104O6(s)+80O2(g)=57CO2(g)+52H2O(l) 已知燃烧1kg该化合物释放出热量3.8104kJ,油酸甘油酯的燃烧热 为 A.3.8×104kJ·mol-1 B.-3.8×104kJ·mol-1 C.3.4×104kJ·mol-1 D.-3.4×104kJ·mol-1 |
|||
答案 |
B | |||
| 题号 | 2 |
|
||
出处 |
2015重庆高考 | |||
| 题干 | 黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: S(s)+2KNO3(s)+ 3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1 已知硫的燃烧热ΔH1= a kJ·mol-1 S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol‾1 2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol‾1 则x为 A .3a+b-c B.c + 3a-b C.a+b-c D.c+a-b |
|||
答案 |
A | |||
| 题号 | 3 |
|
||
出处 |
2017江苏高考 | |||
| 题干 | 通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是 ①C(s) + H2O(g)=CO(g) + H2 (g) ΔH1 = a kJ·mol-1 ②CO(g) + H2O(g)=CO2 (g) + H2 (g) ΔH 2 = b kJ·mol-1 ③CO2 (g) + 3H2 (g) =CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol-1 ④2CH3OH(g)=CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol-1 A.反应①、②为反应③提供原料气 B.反应③也是CO2资源化利用的方法之一 C.反应CH3OH(g)=CH3OCH3 (g) + 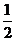 H2O(l)的ΔH = H2O(l)的ΔH =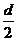 kJ·mol-1 kJ·mol-1D.反应2CO(g) + 4H2 (g)=CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol-1 |
|||
答案 |
C | |||
| 题号 | 4 |
|
||
出处 |
2013上海高考 | |||
| 题干 | 某恒温密闭容器中,可逆反应A(s)  B+C(g);△H>0,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 B+C(g);△H>0,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是A.产物B的状态只能为固态或液态 B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q |
|||
答案 |
BC | |||
| 题号 | 5 |
|
||
出处 |
2015天津高考 | |||
| 题干 | 某温度下,在 2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是A.m=2 B.两次平衡的平衡常数相同 C.X与Y的平衡转化率之比为1:1 D.第二次平衡时,Z的浓度为0.4 mol·L‾1 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2015重庆高考 | |||
| 题干 | 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1。 反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是 COS(g)+H2(g) K=0.1。 反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是A.升高温度,H2S浓度增加,表明该反应是吸热反应 B.通入CO后,正反应速率逐渐增大 C.反应前H2S物质的量为7mol D.CO的平衡转化率为80% |
|||
答案 |
C | |||
| 题号 | 7 |
|
||
出处 |
2007四川高考 | |||
| 题干 | 向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应CO+H2O(g) CO2+H2当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分子大于x的是 CO2+H2当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分子大于x的是A、0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2 B、1mol CO+1mol H2O(g)+1mol CO2 +1mol H2 C、0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4molH2 D、0.5mol CO+1.5mol H2O(g)+0.5molCO2+0.5mol H2 |
|||
答案 |
B | |||
| 题号 | 8 |
|
||
出处 |
2009北京高考 | |||
| 题干 | 已知H2(g)+I2(g) 2HI(g);ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是 2HI(g);ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不改变 C.甲降低温度,乙不变 D.甲增加0.1mol H2,乙增加0.1molI2 |
|||
答案 |
C | |||
| 题号 | 9 |
|
||
出处 |
2012天津高考 | |||
| 题干 | 已知2SO2 (g) + O2 (g)  2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是 2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是A.容器内压强P:P甲=P丙> 2P乙 B.SO3的质量m:m甲=m丙> 2m乙 C.c(SO2)与c(O2)之比k:k甲=k丙> k乙 D.反应放出或吸收热量的数值Q:Q甲=G丙> 2Q乙 |
|||
答案 |
B | |||
| 题号 | 10 |
|
||
出处 |
2017江苏高考 | |||
| 题干 | 常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是 A.浓度均为0.1 mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者 B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 C.0.2 mol·L-1HCOOH与0.1 mol·L-1NaOH等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) D.0.2 mol·L-1CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COO-) > c(Cl-) > c(CH3COOH) > c(H+) |
|||
答案 |
AD | |||
| 题号 | 11 |
|
||
出处 |
2015广东高考 | |||
| 题干 | 一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是 A.升高温度,可能引起有c向b的变化 B.该温度下,水的离子积常数为1.0×10‾13 C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化  |
|||
答案 |
C | |||
| 题号 | 12 |
|
||
出处 |
2015海南高考 | |||
| 题干 | 0.1mol下列气体分别与 1L0.lmol•L‾1的NaOH溶液反应,形成的溶液pH最小的是 A.NO2 B.SO2 C.SO3 D.CO2 |
|||
答案 |
C | |||
| 题号 | 13 |
|
||
出处 |
2010海南高考 | |||
| 题干 | 常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于 A、1.7 B、2.0 C、12.0 D、12.4 |
|||
答案 |
B | |||
| 题号 | 14 |
|
|||||||||||||||
出处 |
2015安徽高考 | ||||||||||||||||
| 题干 | 某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生。为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是
|
||||||||||||||||
答案 |
D | ||||||||||||||||
| 题号 | 15 |
|
||
出处 |
2014安徽 | |||
| 题干 | 室温下,在0.2mol/L Al2(SO4)3溶液中,逐滴加入1.0mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是 A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3+ + 3OH-  Al(OH)3 Al(OH)3B.a-b段,溶液pH增大,Al3+浓度不变 C.b-c段,加入的OH-主要用于生成Al(OH)3沉淀 D.d点时,Al(OH)3沉淀开始溶解  |
|||
答案 |
C | |||
| 题号 | 16 |
|
||
出处 |
2015四川高考 | |||
| 题干 | 常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是 A.  <1.0×10‾7mol/L <1.0×10‾7mol/LB.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+ 2 c(CO32-) D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-) |
|||
答案 |
C | |||
| 题号 | 17 |
|
||
出处 |
2015山东高考 | |||
| 题干 | 室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是 A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)= c(A—)+ c(HA) D.b点所示溶液中c(A—)> c(HA) 
|
|||
答案 |
D | |||
| 题号 | 18 |
|
||
出处 |
2015广州综合1 | |||
| 题干 | 常温下,下列离子浓度关系正确的是 A.pH=4的CH3COOH溶液中,c(H+)= c(CH3COO-)=4.0mol·L-1 B.pH=5的CH3COOH和CH3COONa混合溶液中,c(CH3COO-)>c(Na+) C.0.1 mol·L-1CH3COONa溶液中,c(Na +)>c(OH-)>c(CH3COO-)>c(H+) D.0.1 mol·L-1CH3COONa溶液中,c(Na +)= c(CH3COO-)+ c(OH-) |
|||
答案 |
B | |||
| 题号 | 19 |
|
||
出处 |
2015海淀期末 | |||
| 题干 | 关于0.1mol·L-1NaHCO3溶液,下列说法正确的是 A.溶质水解反应:HCO3- +H2O  H3O++CO32- H3O++CO32-B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-) D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)] |
|||
答案 |
C | |||
| 题号 | 20 |
|
||
出处 |
2013龙岩期末 | |||
| 题干 | 现有体积相同、pH均为2的盐酸和醋酸,下列叙述错误的是 A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) D.它们分别与足量CaCO3反应时,放出的CO2一样多 |
|||
答案 |
D | |||
| 题号 | 21 |
|
||
出处 |
2016天津高考 | |||
| 题干 | 室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是 A.三种酸的电离常数关系:K(HA)>K(HB)>K(HD) B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)  |
|||
答案 |
C | |||
| 题号 | 22 |
|
||
出处 |
2016海南高考 | |||
| 题干 | 向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是 A.c(CO32-) B.c(Mg2+) C.c(H+) D.Ksp(MgCO3) |
|||
答案 |
A | |||
| 题号 | 23 |
|
||
出处 |
2017全国Ⅲ卷 | |||
| 题干 | 在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 A.Ksp(CuCl)的数量级为10-7 B.除Cl-反应为Cu+Cu2++2Cl-=2CuCl C.加入Cu越多,Cu+浓度越高,除Cl-效果越好 D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 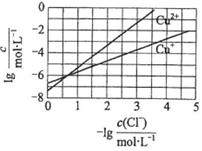 |
|||
答案 |
C | |||
| 题号 | 24 |
|
||
出处 |
2016广州二模 | |||
| 题干 | 25℃时,已知Ksp(Ag2SO4)=1.2×10﹣5,Ksp(AgCl)=1.8×10﹣10,Ksp(Ag 2C2O4)=3.5×10﹣11,Ksp(AgI)=1.5×10﹣16,该温度下有关叙述正确的是 A.AgCl、Ag 2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag 2C2O4>AgCl>AgI B.将0.02 mol•L﹣1AgNO3溶液和0.02 mol•L﹣1 Na2SO4溶液等体积混合,有沉淀生成 C.向5mL饱和AgCl溶液中滴加0.5mL 0.1 mol•L﹣1KI溶液,无沉淀生成 D.向浓度均为0.1mol•L﹣1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
|||
答案 |
A | |||
| 题号 | 25 |
|
||
出处 |
2017江苏高考 | |||
| 题干 | 下列说法正确的是 A.反应N2(g) +3H2(g)  2NH3(g)的ΔH < 0,ΔS >0 2NH3(g)的ΔH < 0,ΔS >0 B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 C.常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4mol·L-1 D.常温常压下,锌与稀H2SO4反应生成 11.2 LH2,反应中转移的电子数为6.02×1023 |
|||
答案 |
BC | |||
| 题号 | 26 |
|
||
出处 |
2017天津高考 | |||
| 题干 | 下列能量转化过程与氧化还原反应无关的是 A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能 C.电解质溶液导电时,电能转化成化学能 D.葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
|||
答案 |
A | |||
| 题号 | 27 |
|
||
出处 |
2017全国卷I | |||
| 题干 | 支持海港码头基础的防腐技术,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 |
|||
答案 |
C | |||
| 题号 | 28 |
|
||
出处 |
2017全国II卷 | |||
| 题干 | 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。下列叙述错误的是 A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为:Al3++3e-=Al D.硫酸根离子在电解过程中向阳极移动 |
|||
答案 |
C | |||
| 题号 | 29 |
|
||
出处 |
2017全国Ⅲ卷 | |||
| 题干 | 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是 A.电池工作时,正极可发生反应:2Li2S6+2Li++2e- =3Li2S4 B.电池工作时,外电路中流过0.02 mol电子,负极材料减重 0.14 g C.石墨烯的作用主要是提高电极a的导电性 D.电池充电时间越长,电池中的Li2S2量越多  |
|||
答案 |
D | |||
| 题号 | 30 |
|
|||||||||
出处 |
2016北京高考 | ||||||||||
| 题干 | 用石墨电极完成下列电解实验。
A、a、b处:2H2O+2e-=H2↑+2OH- B、b处:2Cl-+2e-=Cl2↑ C、c处发生了反应:Fe-2e-=Fe2+ D、根据实验一的原理,实验二中m处能析出铜 |
||||||||||
答案 |
B | ||||||||||
| 题号 | 31 |
|
||
出处 |
2008宁夏高考 | |||
| 题干 | 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。 该电池负极发生的反应是 A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e- B.O2(g)+4H+(aq)+4e_=2H2O(1) C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e- D.O2(g)+2H2O(1)+4e-=4OH- |
|||
答案 |
C | |||
| 题号 | 32 |
|
||
出处 |
2015广州综合1 | |||
| 题干 | 某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,闭合K后,下列叙述正确的是 A.电子方向:电极Ⅳ→Ⅰ B.电极Ⅱ电极反应:O2+2H2O+4e-=4OH- C.电极Ⅲ发生还原反应 D.电极Ⅳ附近观察到黄绿色气体  |
|||
答案 |
B | |||
| 题号 | 33 |
|
||
出处 |
2009海淀期中 | |||
| 题干 | (1)中和热的测定实验(如图)。 ①量取反应物时,取50mL0.50mol·L-1的盐酸, 还应加入的试剂是 (填序号)。 A.50mL0.50mol·L-1NaOH溶液 B.50mL0.55mol·L-1NaOH溶液 C.1.0gNaOH固体 ②在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。 A.盐酸的浓度 B.盐酸的温度 C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度 E.水的比热容 F.反应后混合溶液的终止温度 ③若用50mL0.5mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据 。(填“偏大”或“偏小”或“不变”) |
|||
答案 |
(1)① B②B、D、F③偏小 | |||
| 题号 | 34 |
|
||||||||
出处 |
2017天津高考 | |||||||||
| 题干 | 用沉淀滴定法快速测定NaI等碘化物溶液中c(I−),实验过程包括准备标准溶液和滴定待测溶液。 Ⅰ.准备标准溶液 a.准确称取AgNO3基准物 4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。 b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。 Ⅱ.滴定的主要步骤 a.取待测NaI溶液25.00 mL于锥形瓶中。 b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I−完全转化为AgI沉淀。 c.加入NH4Fe(SO4)2溶液作指示剂。 d.用0.1000 mol·L−1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。 e.重复上述操作两次。三次测定数据如下表:
回答下列问题: (1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有__________。 (2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是___________________________。 (3)滴定应在pH<0.5的条件下进行,其原因是___________________________________。 (4)b和c两步操作是否可以颠倒________________,说明理由________________________。 (5)所消耗的NH4SCN标准溶液平均体积为_____mL,测得c(I-)=_________________mol·L-1。 (6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为________________________。 (7)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”) ①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_______________。 ②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果______________。 |
|||||||||
答案 |
(1)250 mL(棕色)容量瓶、胶头滴管 (2)避免AgNO3见光分解 (3)防止因Fe3+的水解而影响滴定终点的判断(或抑制Fe3+的水解) (4)否(或不能) 若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点 (5)10.00 0.0600 (6)用NH4SCN标准溶液进行润洗 (7)偏高 偏高 |
|||||||||
| 题号 | 35 |
|
||
出处 |
2017全国Ⅲ卷 | |||
| 题干 | 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下: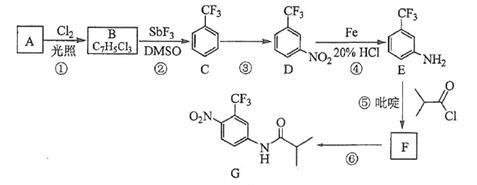 回答下列问题: (1)A的结构简式为____________。C的化学名称是______________。 (2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。 (3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。 (4)G的分子式为______________。 (5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__种。 (6)4-甲氧基乙酰苯胺( 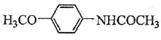 )是重要的精细化工中间体,写出由苯甲醚( )是重要的精细化工中间体,写出由苯甲醚(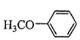 )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。 )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。 |
|||
答案 |
(1)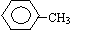 ,三氟甲苯;(2)浓硝酸、浓硫酸,并加热 取代反应; ,三氟甲苯;(2)浓硝酸、浓硫酸,并加热 取代反应;(3) 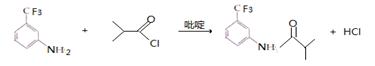 吸收反应产物的HCl,提高反应转化率 (4)C11H11O3N 2F3 (5)9种 (6) 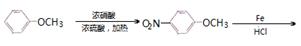 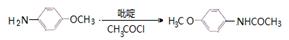 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |