 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 广东省广州市2017届高三12月模拟理综化学试题 | |
|---|---|
| 本卷共有试题:12 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
|||||||||||||||
出处 |
2017广州12月模拟 | ||||||||||||||||
| 题干 | 化学在生活中有着广泛的应用,下列对应关系错误的是
|
||||||||||||||||
答案 |
A | ||||||||||||||||
| 题号 | 2 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 下列实验操作能达到实验目的的是 A.用排水法收集铜粉与浓硝酸反应产生的NO2 B.用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 C.用酸性KMnO4溶液验证草酸的还原性 D.用饱和NaHCO3溶液除去Cl2中混有的HCl |
|||
答案 |
C | |||
| 题号 | 3 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 设NA为阿伏加德罗常数的值。下列有关叙述正确的是 A.标准状况下, 22.4 LCH4含有的共价键数为NA B.1 mol Fe与1mol Cl2充分反应,电子转移数为3NA C.常温下,pH =2的醋酸溶液中含有的H+数目为0.02NA D.常温常压下, 46g的NO2和N2O4混合气体含有的原子数为3NA |
|||
答案 |
D | |||
| 题号 | 4 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是 A.通电后阳极区溶液pH增大 B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成 D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 |
|||
答案 |
D | |||
| 题号 | 5 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 用下列装置完成相关实验,合理的是 图① 图② 图③ 图④ A.图①:验证H2CO3酸性强于H2SiO3 B.图②:收集CO2或NH3 C.图③:分离Na2CO3溶液与CH3COOC2H5 D.图④:分离CH3CH2OH与CH3COOC2H5 |
|||
答案 |
B | |||
| 题号 | 6 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是 A.单质的沸点:Z>W B.简单离子半径:X>W C.元素X与氧可形成既含离子键也含非极性共价键的化合物 D.X、Y、Z的最高价氧化物对应的水化物能相互反应 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 25℃时,用0.1000 mol·L-1NaOH溶液分别滴定20.00ml 0.1000 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是 A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等 C.V(NaOH) =10.00mL时,醋酸溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.V(NaOH) =20.00mL时,两溶液中c(CH3COO-)>c(Cl-)  |
|||
答案 |
C | |||
| 题号 | 8 |
|
||||||||||||
出处 |
2017广州12月模拟 | |||||||||||||
| 题干 | Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2。回答下列问题: (1)装置A的作用是制备________,反应的化学方程式为________。 (2)完成下表实验过程:
|
|||||||||||||
答案 |
(1)SO2 H2SO4+Na2SO3 =SO2↑+H2O+Na2SO4 (2)①S2-+ H2O  HS-+ OH- HS-+ OH- ②溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少) ③减小 ④关闭K1、K2,打开K3 ⑤SO2过量会使溶液酸度增加,使产物分解,降低产率 (3)加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成 |
|||||||||||||
| 题号 | 9 |
|
||||||||||||||||||||||||
出处 |
2017广州12月模拟 | |||||||||||||||||||||||||
| 题干 | 研究CO、NOx、SO2等的处理方法对环境保护有重要意义。 (1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为: 2NO(g)+2CO(g) 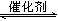 2CO2(g)+N2(g) △H=-746.8kJ·mol-1 2CO2(g)+N2(g) △H=-746.8kJ·mol-1①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是___________。 (已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
 (2)一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)  SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=_______。 SO3(g)+NO(g),达到平衡时SO3的体积分数为25%。该反应的平衡常数K=_______。(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。 |
|||||||||||||||||||||||||
答案 |
(1)①Ⅱ、Ⅰ、Ⅲ ②温度 该反应为放热反应,温度升高,平衡向左移动,α(NO)降低;该反应为气体分子数减小的反应,压强增大,平衡向右移动,α(NO)增大(4分) 压强 < (2)1.8 (3)变小 2NO2+8e-+4H2O=N2+8OH- |
|||||||||||||||||||||||||
| 题号 | 10 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线: 已知:(NH4)2SO4在 350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第ⅣA族。 (1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________。 (2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。 (3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的________倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________。  (4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp(CaF2)=4.0×10-11] (5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是________。 |
|||
答案 |
(1)增大接触面积,加快反应速率,使反应更充分 (2)Fe3++2H2O  FeO(OH)↓+3H+ SiO2、CaSO4 FeO(OH)↓+3H+ SiO2、CaSO4(3)0.5 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (4)2.0×10-3 (5)0.25 |
|||
| 题号 | 11 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题: (1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为________,S、O、N三种元素的第一电离能由大到小为________。 (2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为________(填化学式)。 (3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有________。 (4)CuSO4的熔点为 560℃,Cu(NO3)2的熔点为 115℃,CuSO4熔点更高的原因是________。 (5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。  ①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(  , , , , )。则D原子的坐标参数为________,它代表________原子。 )。则D原子的坐标参数为________,它代表________原子。②若Cu2O晶体密度为d g·cm-3,晶胞参数为apm,则阿伏加德罗常数值NA=________。 |
|||
答案 |
(1)[Ar]3d9 N>O>S (2)正四面体 CCl4(或SiF4等) (3)sp2 配位键、离子键 (4)CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高。 (5)①(  ; ; ; ; ) Cu ② ) Cu ② |
|||
| 题号 | 12 |
|
||
出处 |
2017广州12月模拟 | |||
| 题干 | 化合物M是一种香料,A与D是常见的有机化工原料,按下列路线合成化合物M: 已知以下信息: ①A的相对分子质量为28  回答下列问题: (1)A的名称是________,D的结构简式是________。 (2)A生成B的反应类型为________,C中官能团名称为________。 (3)E生成F的的化学方程式为________。 (4)下列关于G的说法正确的是________。(填标号) a.属于芳香烃 b.可与FeCl3溶液反应显紫色 c.可与新制的Cu(OH)2共热生成红色沉淀 d.G分子中最多有14个原子共平面 (5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有________种(不考虑立体异构)。 ①与化合物M含有相同的官能团;②苯环上有两个取代基 (6)参照上述合成路线,化合物X与Y以物质的量之比2:1反应可得到化合物  |
|||
答案 |
(1)乙烯  (2)加成反应 醛基 (3)  (4)cd (5)18(3分) (6)CH3CH2CHO  |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |