 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 《氯及其化合物复习专题》 | |
|---|---|
| 本卷共有试题:13 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
未知 | |||
| 题干 | 印染工业常用亚氯酸钠(NaClO2)漂白织物。亚氯酸钠在溶液中可生成ClO2、HClO2、ClO,其中HClO2是漂白剂的有效成分,ClO2是有毒气体。各组分含量随pH变化情况如图所示,由图可知,使用该漂白剂的最佳pH为 A.3.0 B.4.0~4.5 C.6.5~7.0 D.9.0  |
|||
答案 |
B | |||
| 题号 | 2 |
|
||
出处 |
未知 | |||
| 题干 | 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol/L。如果在甲中加入少量的碳酸氢钠晶体m mol,在乙中加入少量的亚硫酸氢钠晶体m mol,丙瓶不变,片刻后,甲乙丙三溶液中HClO的物质的量浓度大小关系是(溶液体积变化不计) A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
未知 | |||
| 题干 | 氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中不正确的是( ) A、在CCl4中的溶解性BrCl<Br2 B、BrCl氧化性比Br2强 C、BrCl能使润湿的淀粉碘化钾试纸变蓝 D、常温下BrCl可与NaOH溶液反应生成NaClO和NaBr |
|||
答案 |
D | |||
| 题号 | 4 |
|
||
出处 |
未知 | |||
| 题干 | 通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹(原子序数为85)及其化合物的叙述中肯定不正确的是 A.由KAt的水溶液制备砹的化学方程式为2KAt+Cl2===2KCl+At2 B.相同条件下HAt比HI稳定 C.AgAt是一种难溶于水的化合物 D.At元素位于第六周期 |
|||
答案 |
B | |||
| 题号 | 5 |
|
||
出处 |
未知 | |||
| 题干 | 漂粉精久置于空气中会变质,在变质过程中不会涉及的性质是 A.HClO的漂白性 B.HClO的不稳定性 C.HClO的弱酸性 D.H2CO3的酸性 |
|||
答案 |
A | |||
| 题号 | 6 |
|
||
出处 |
未知 | |||
| 题干 | 常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是 A.a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-) B.b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-) C.c点所示的溶液中c(Na+)=c(HClO)+c(ClO-) D.d点所示的溶液中c(Na+) c(ClO-) >c(Cl-) >c(HClO) |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
未知 | |||
| 题干 | 自来水常用氯气进行消毒。如果在实验室用自来水配制下列物质的溶液,不会产生明显药品变质问题的是 A.FeCl2 B.Na2SO3 C.NaOH D.AlCl3 |
|||
答案 |
D | |||
| 题号 | 8 |
|
||
出处 |
未知 | |||
| 题干 | 氯磺酸(HSO3C1)是一种容易水解的一元强酸,可以在常温下用HCl+SO3=HSO3Cl制得,下列说法正确的是 A.HS03Cl与H20反应产物为H2S04和HCl B.HSO3Cl与NaOH溶液反应生成产物只有NaS03Cl C.HSO3Cl也可以用浓盐酸与浓硫酸反应制得 D.O.1mol的HSO3Cl与HCl分别溶于水制得1L溶液,两者pH都等于1 |
|||
答案 |
A | |||
| 题号 | 9 |
|
||
出处 |
未知 | |||
| 题干 | 实验表明:将氯水滴加到一片蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是() A.此实验表明氯水具有酸性、漂白性 B.内环呈白色外环呈红色或浅红色 C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 D.氯水中形成次氯酸的反应中还原产物是HClO |
|||
答案 |
D | |||
| 题号 | 10 |
|
||
出处 |
未知 | |||
| 题干 | 某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。 (1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 装置(填装置序号)制Cl2。 (2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B: ,D: 。 (3) 装置C的作用是 。 (4) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:  ①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: 。 ②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ,并写出其相应的离子方程式: 。 ③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: 。 |
|||
答案 |
(1) E (2) B:溶液由无色变成红色 D:溶液没有明显的变化 (3) 保证安全,吸收多余的氯气和二氧化硫 (4)①使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合。 ②SO2和Cl2按1:1进气,二者恰好完全反应,生成无漂白性的H2SO4和HCl SO2 +Cl2 +2H2O===4H+ +SO42- +2Cl- ③SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。 |
|||
| 题号 | 11 |
|
||
出处 |
未知 | |||
| 题干 | 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白剂和杀菌。以下是用过氧化氢法生产亚氯酸钠的工艺流程图: 已知:NaOH溶液(160g·L-1)是指每升溶液中含溶质160 g。 试回答下列问题: (1)该NaOH溶液的物质的量浓度为 。 (2)在吸收塔中,ClO2、NaOH与H2O2反应生成NaClO2和O2,则该反应中还原剂与氧化剂的物质的量之比为 。 (3)NaClO2较稳定,但其固体在加热时或敲击时会立即发生爆炸,其爆炸后的产物可能是 (填字母) A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3 (4)NaClO3与SO2反应生成ClO2,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目: 。 |
|||
答案 |
(1)4mol/L (2)1:2(3)D (4)  |
|||
| 题号 | 12 |
|
||
出处 |
未知 | |||
| 题干 | 二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。 Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。 Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: 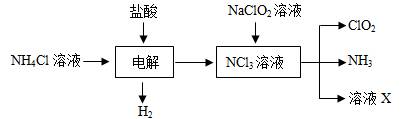 (2)写出电解时发生反应的化学方程式: ; (3)除去ClO2中的NH3可选用的试剂是 ;(填序号) A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水 (4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。  ①装置中玻璃液封管的作用是 ; ②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ; ③滴定终点的现象是: 。 ④测得通入ClO2的质量m(ClO2)= 。(用含c、V的代数式表示) (5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中 ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是 (填化学式)。 |
|||
答案 |
(1)1:2(2) NH4Cl+2HCl (3)C(1分) (4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等 ②2ClO2+2I-+8H+=4H2O+I2+2Cl- ③最后一滴滴下时,溶液由蓝色变为无色,且半分钟内不复原 ④1.35cv×10-2g (4)Fe(OH)3 |
|||
| 题号 | 13 |
|
||
出处 |
未知 | |||
| 题干 | 二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。 Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。 Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:  (2)写出电解时发生反应的化学方程式: ; (3)除去ClO2中的NH3可选用的试剂是 ;(填序号) A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水 (4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。  ①装置中玻璃液封管的作用是 ; ②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ; ③滴定终点的现象是: 。 ④测得通入ClO2的质量m(ClO2)= 。(用含c、V的代数式表示) (5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中 ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是 (填化学式)。 |
|||
答案 |
(1)1:2(2) NH4Cl+2HCl (3)C(1分) (4)①吸收残余的二氧化氯气体,并使锥形瓶内外压强相等 ②2ClO2+2I-+8H+=4H2O+I2+2Cl- ③最后一滴滴下时,溶液由蓝色变为无色,且半分钟内不复原 ④1.35cv×10-2g (4)Fe(OH)3 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |