 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2012年全国各校试题精选(十) | |
|---|---|
| 本卷共有试题:15 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
未知 | |||
| 题干 | “荧光粉”所用的高纯度氯化钙中若混有镁离子,除去的方法是把氯化钙的水溶液加热到90-95℃,在不断搅拌的条件下加入适当的沉淀剂,使镁离子生成沉淀过滤除去。此沉淀剂最好是 A. 烧碱 B. 纯碱 C. 小苏打 D. 石灰浆 |
|||
答案 |
D | |||
| 题号 | 2 |
|
||
出处 |
未知 | |||
| 题干 | 下列说法正确的是 A.醋酸纤维、橡胶、腈纶都属于合成高分子化合物 B.加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖 C.油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
未知 | |||
| 题干 | 已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)= 6.8×10 - 4 mol·L-1、 Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)= 6.4×10 - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是 A.HCN溶液 B.HF溶液 C.CH3COOH溶液 D.HNO2溶液 |
|||
答案 |
B | |||
| 题号 | 4 |
|
||
出处 |
未知 | |||
| 题干 | 在容积不变的密闭容器中有反应:X(g) + Y(g)  z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如右图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是 z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如右图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是A. A点与B点相比,B点的c (X)大 B. A点与C点的化学反应速率:前者<后者 C.在反应进行到D点时,V正>V逆 D.该反应的正反应是吸热反应  |
|||
答案 |
D | |||
| 题号 | 5 |
|
||
出处 |
未知 | |||
| 题干 | 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的先后离子方程式是 ①CO2+OH-=HCO3- ②CO2+2OH-=CO32-+H2O ③CO32-+Ba2+=BaCO3↓ ④BaCO3+CO2+H2O=Ba2++2HCO3- ⑤CO32-+CO2+H2O=2HCO3- A.②⑤ B.⑤④ C.④② D.④① |
|||
答案 |
A | |||
| 题号 | 6 |
|
||
出处 |
未知 | |||
| 题干 | 工业生产的生石灰中常混有二氧化硅和石灰石。现将该生石灰样品溶于过量的盐酸中。然后在不断搅拌(必要时可以加热)的情况下,向反应混合物中逐滴加入氢氧化钠溶液至过量,如果纵坐标表示固体难溶物的质量(m),横坐标表示所加入氢氧化钠溶液的体积(V),则下列图示正确的是 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
未知 | |||
| 题干 | 将几滴KSCN(SCN-是“类卤离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成红色,将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。下列说法不正确的是 A.①红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失 B.②红色褪去的原因是SO2将Fe3+还原为Fe2+ C.②红色褪去的原因是SO2将SCN-还原 D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
|||
答案 |
C | |||
| 题号 | 8 |
|
||
出处 |
未知 | |||
| 题干 | 要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为 ①加入足量氯水②加入足量KMnO4③加入少量NH4SCN溶液 A.①③ B.③② C.③① D.①②③ |
|||
答案 |
C | |||
| 题号 | 9 |
|
||
出处 |
未知 | |||
| 题干 | 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系(溶液体积变化忽略不计) A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲 |
|||
答案 |
B | |||
| 题号 | 10 |
|
||
出处 |
未知 | |||
| 题干 | 青石棉是一种致癌物质,其化学式为Na2Fe5Si8O22(OH)2 。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是 A.青石棉不属于硅酸盐原料 B.青石棉中含有一定量的石英晶体 C.青石棉属于新型无机非金属材料 D.1 mol青石棉能使1 mol稀硝酸被还原 |
|||
答案 |
D | |||
| 题号 | 11 |
|
||
出处 |
未知 | |||
| 题干 | 常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是 A.①与②中c(H+)相同 B.①与④混合,溶液中c(CH3COO-) =c(Na+) C.②和③混合,所得混合溶液的pH等于7 D.③与④分别用等浓度的盐酸中和,消耗盐酸的体积相 |
|||
答案 |
A | |||
| 题号 | 12 |
|
||
出处 |
未知 | |||
| 题干 | 已知反应:CO (g) + H2O(g) CO2 (g) + H2(g) CO2 (g) + H2(g)(1)将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/3的CO转化为CO2。则该反应平衡常数的表达式为 ,此温度下平衡常数为 。 (2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较, 平衡应 移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的 (填编号) A. 22.2% B.27.55% C.33.3% D.36.8% (3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比较,则下列说法中正确的是 (填序号) ①生成物的产量一定增加 ②反应物的浓度一定降低 ③反应物的转化率一定增加 ④CO在平衡混合气中的百分含量一定降低 |
|||
答案 |
(1) Kc= ;4; (2)不; C; (3)①④ ;4; (2)不; C; (3)①④ |
|||
| 题号 | 13 |
|
||||||||
出处 |
未知 | |||||||||
| 题干 | 某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气后,进行以下实验: (1)检验吸收液中的SO42–: ,证明Fe3+能够把H2SO3氧化成SO42–。 (2)请配平并完成上述反应中的化学方程式: 2FeCl3+SO2+ == +H2SO4+ ,反应中的氧化产物是 (写化学式)。 (3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究: ①提出假设。 假设1:溶液中存在Fe3+、Fe2+; 假设2:溶液中存在 ②设计方案、进行实验,验证假设。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:试管、滴管、0.1moLL-1KMnO4、0.1moLL-1KSCN溶液、品红稀溶液。
|
|||||||||
答案 |
(1)取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀 (2)2H2O;2FeCl2;2HCl;H2SO4 (3)①Fe2+、H2SO3②
(2)由于用FeCl3溶液吸收制取SO2气体,Fe3+可以氧化H2SO3,故Fe3+与H2SO3不能共存,溶液中有H2SO3就一定有Fe2+。所以用品红验证了H2SO3的存在就不必再验证Fe2+。] |
|||||||||
| 题号 | 14 |
|
||
出处 |
未知 | |||
| 题干 | 工业尾气中的氮氧化物常用氨催化吸收法,原理是NH3与NOx反应生成无毒物质。某同学采用以下装置和步骤模拟工业上氮氧化物的处理过程。 (一)提供的装置  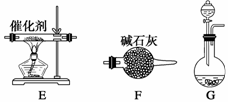 (二)NH3的制取 (1)下列有关实验室制备气体的说法正确的是___ _____(填序号)。 ①可以用排饱和食盐水的方法收集氯气 ②用赤热的炭与水蒸气反应制取氢气 ③实验室制氧气有时需要加热,有时不需要加热 ④用无水氯化钙干燥氨气 ⑤用浓盐酸洗涤高锰酸钾分解制氧气的试管 (2)从所提供的装置中选取一个能制取氨气的装置:__________ ______(填序号)。 (3)当采用你所选用的装置制取氨气时,相应反应的化学方程式是_______ ___________。 (三)模拟尾气的处理 选用上述部分装置,按下列顺序连接成模拟尾气处理装置,回答有关问题:  (4)A中反应的离子方程式为____________________________________________。 (5)D装置中的液体可换成___ _____(填序号)。 a.CuSO4 b.H2O c.CCl4 d.浓硫酸 (6)该同学所设计的模拟尾气处理实验还存在的明显缺陷是___________________。 |
|||
答案 |
(1)①③⑤ (2)C或G (3)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O或CaO+NH3·H2O===NH3↑+Ca(OH)2(要对应) (4)3Cu+2NO+8H+===3Cu2++2NO↑+4H2O (5)c (6)NO尾气直接排放,没有进行处理 |
|||
| 题号 | 15 |
|
||
出处 |
未知 | |||
| 题干 | 以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—99.3%)的工艺流程为(可能用到的原子量Cl 35.5 Ca 40 O 16) (1)CaCO3与盐酸反应的离子方程式 。 (2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。 ②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。 (3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为: ① ,②防止Ca2+在蒸发时发生水解。 (4)操作Ⅰ中应包括 、 、过滤等实验步骤。 (5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。 ①通过计算,样品含CaCl2·2H2O的质量百分数为 .(只写计算式不计算结果)。 ②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。 |
|||
答案 |
(1)CaCO3+2H+=Ca2++CO2↑+H2O(3分) (2)①Al(OH)3、Fe(OH)3,②普通漏斗 (3)除去过量的氢氧化钙(2分,合理则给分); (4)(蒸发、结晶),(或写蒸发浓缩、降温结晶) (5)①  ②样品中存在少量的NaCl (合理则给分如少量的CaCl2·2H2O失水等) |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |