A.铝粉在氧气中燃烧生成Al2O3,则铁丝在氧气中燃烧生成Fe2O3
B.铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜
C.碳在少量氧气中燃烧生成CO、在过量氧气中燃烧生成CO2,则硫在少量氧气中燃烧生成SO2、在过量氧气中燃烧生成SO3
D.钠与氧气、水等反应时钠均作还原剂,则金属单质参与反应时金属单质均作还原剂
2.下列各物质分别滴入少量Al2(SO4)3溶液中,能发生反应且最终无白色沉淀存在的是
A.BaCl2溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
3.将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的
A. 1/6 B. 1/3 C. 2/3 D. 1/2
4.在FeCl3溶液中,加入过量的铜粉,充分反应后,溶液中存在的金属离子是
A.Fe2+ 和Cu2+ B.Fe3+ C.Cu2+ D.Fe2+
5.下列物质中,主要成分不是硅酸盐的是
A.大理石 B.玻璃 C.陶瓷 D.水泥
6.下列说法正确的是
A.摩尔是一种国际基本物理量
B.标准状况下气体摩尔体积约为22.4 L
C.氢的摩尔质量是2 g/mol
D.在同温同压下,相同体积的任何气体单质所含分子数相同
7.下列带括号的气体在反应中只做氧化剂的是
A.2F2(g) + 2H2O = 4HF + O2
B.SO2(g) + I2 +2H2O = H2SO4 + 2HI
C.H2S(g) + Br2 = 2HBr + S↓
D.3NO2(g) + H2O = 2HNO3 + NO
8.下列仪器中一般不能用作反应容器的是
A.容量瓶 B.烧瓶 C.烧杯 D.试管
9.在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别:
A.酚酞试液 B.氯化钡溶液 C.氢氧化钠溶液 D.硝酸银溶液
10.少量金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是
A.HCl B.NaCl C.AlCl3 D.Na2SO4
11.实验室用18mol/L的浓硫酸配制2mol/L的稀硫酸时,下列做法正确的是
A.稀释浓硫酸后没有冷却就转移到容量瓶中
B.定容时凹液面正好与刻度线相切
C.定容后把容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线
D.配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果
12.下列离子方程式书写正确的是
A.大理石与盐酸反应:CO32-+ 2H+ =H2O+CO2↑
B.氢氧化铝固体与盐酸反应:H+ + OH-=H2O
C.氯化镁溶液中滴入氢氧化钠溶液:MgCl2 + 2OH-=Mg(OH)2↓+2Cl-
D.氯化钡溶液中滴入硫酸钠溶液:Ba2+ + SO42-=BaSO4↓
13.下列物质中属于酸的是
A.NaHCO3 B.HClO3 C.NH3 D.CH4
14.agCuO通入CO后,在加热条件下,全部还原为bgCu,求Cu的相对原子质量(用代数式表示)。
15.下列反应可以用离子方程式Ba2++SO42-=BaSO4↓来表示的是
A.Ba(OH)2+H2SO4=BaSO4↓+2H2O
B.BaCl2+Na2SO4=BaSO4↓+2NaCl
C.BaCO3+H2SO4=BaSO4↓+CO2↑+H2O
D.Ba(OH)2+CuSO4=BaSO4↓+Cu(OH)2↓
16.金属钠的化学性质很活泼,它在空气中很容易变质,可以与冷水发生剧烈反应。
(1)钠在上述空气、冷水中发生反应中 (填“得”或“失”)电子,表现出 性(填“氧化”或“还原”)。
(1)少量的金属钠应该保存在 中。
(2)请写出钠与水反应的化学方程式 。
(3)请在你写出的方程式上标出电子转移的方向和数目
(4)当有0.2mol电子发生转移时,生成氢气的体积为 (标准状况)
17.称取14.2g无水硫酸钠固体(摩尔质量为142g/mol)溶于适量水中,再稀释至100mL。回答下列问题:
(1)写出硫酸钠在水溶液中的电离方程式: 。
(2)从配制所得的溶液中取出10mL,该10mL的溶液中硫酸钠的物质的量浓度为: 。
(3)14.2g该固体中含有钠离子的数目是
18.某研究性学习小组为探究二氧化硫的还原性,查阅到如下资料:
| 资料卡 NO:2006-K1-001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡,放置片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如:H2SO3+I2+H2O=H2SO4+2HI |
(1)把足量SO2通入适量的碘水中,可能观察到的现象是
(2)证明SO2被氧化为SO42-所使用的试剂是
(3)如果该探究小组想利用上述原理除去CO2中的SO2,并检验是否除尽,下列方案可行的是 (填字母)
A、将混合气体通过碘水,再通过品红溶液
B、将混合气体通过氯化钡和过氧化氢混合溶液,再通过碘水溶液
C、将混合气体通过NaOH溶液再通过品红溶液
D、将混合气体浓硫酸溶液,再通过品红溶液
(4)若该探究小组就上述实验提出把含+4价硫元素化合物转化为含+6价硫元素化合物的条件,下列试剂可以实现上述转化的是 (填字母)
A、氧气 B、MnO4- C、氯气 D、浓硫酸
19.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + C —— AlN + CO (未配平)
⑴在该反应中,氧化剂是______________,还原剂是_______________。
⑵若生成1mol的AlN,则转移电子的数目约为____________________________。
20.置换反应的通式可表示为:

请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为
。
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3
 Al2O3+2Fe。
Al2O3+2Fe。除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为 。
21.为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 | 选项的标号 |
| 分离FeSO4和Fe2(SO4)3 | |
| 从碘水中提取碘单质 | |
| 提纯混有少混NaCl的KNO3 | |
| 除去Na2CO3固体中的NaHCO3 |
供选择的化学试剂及实验方法
A、加热灼烧
B、在较高温度下溶于水配成浓溶液,再冷却结晶
C、加入四氯化碳萃取
D、加入适量的铁屑
22.甲、乙、丙三位同学分别采用如下图所示的甲、乙、丙三套方案验证铜与稀硝酸的反应。
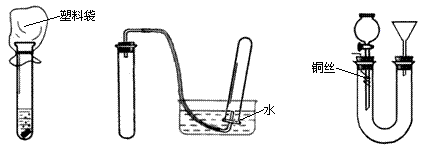
方案甲 方案乙 方案丙
(1)请写出铜与稀硝酸反应的化学方程式: 。
(2)能说明铜被氧化成铜离子的现象是 。
(3)甲、乙两位同学设计的方案不具有足够的说服力以说明铜与稀硝酸反应一定生成NO气体,请你说明理由。
| 方案序号 | 理 由 |
| 方案甲 | |
| 方案乙 |
(5)从环境保护角度来说,方案丙存在缺陷,存在的缺陷是