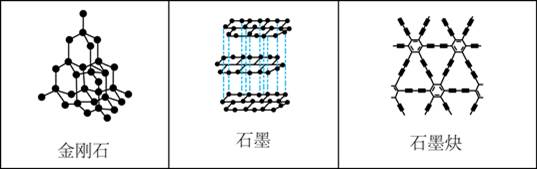
下列关于金刚石、石墨、石墨炔的说法正确的是
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
2.下列化学用语或图示表达正确的是
A.NaCl的电子式为

B.NH3的VSEPR模型为
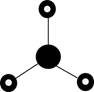
C.2Pz电子云图为
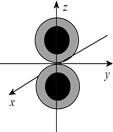
D.基态24Cr原子的价层电子轨道表示式为

3.下列过程与水解反应无关的是
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
4.下列事实能用平衡移动原理解释的是
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓HNO3中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀H2SO4反应过程中,加入少量CuSO4固体,促进H2的产生
5.回收利用工业废气中的CO2和SO2,实验原理示意图如下。
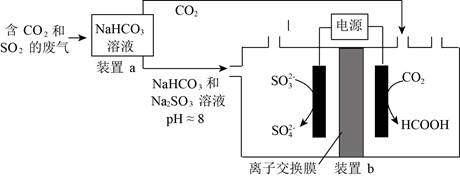
下列说法不正确的是
A.废气中SO2排放到大气中会形成酸雨
B.装置a中溶液显碱性的原因是HCO3-的水解程度大于HCO3-的电离程度
C.装置a中溶液的作用是吸收废气中的CO2和SO2
D.装置b中的总反应为SO32-+CO2+H2O
 HCOOH+SO42-
HCOOH+SO42-6.下列离子方程式与所给事实不相符的是
A.Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH-=Cl-+ClO-+H2O
B.食醋去除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C.利用覆铜板制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+
D.Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
7.蔗糖与浓硫酸发生作用的过程如图所示。

下列关于该过程的分析不正确的是
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中蔗糖分子发生了化学键的断裂
8.完成下述实验,装置或试剂不正确的是
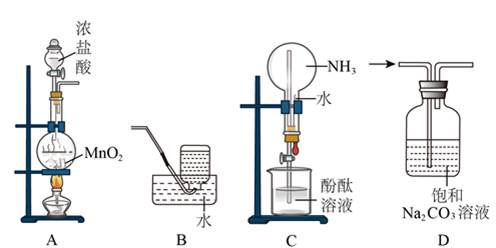
A.实验室制Cl2 B.实验室收集C2H4
C.验证NH3易溶于水且溶液呈碱性 D.除去CO2中混有的少量HCl
9.一种聚合物PHA的结构简式如下,下列说法不正确的是
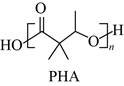
A.PHA的重复单元中有两种官能团
B.PHA可通过单体
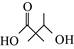 缩聚合成
缩聚合成C.PHA在碱性条件下可发生降解
D.PHA中存在手性碳原子
10.下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A.F-F键的键能小于Cl-Cl键的键能
B.三氟乙酸的Ka大于三氯乙酸的Ka
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF)2,而气态氯化氢中是HCl分子
11.化合物K与L反应可合成药物中间体M,转化关系如下。
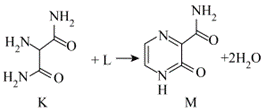
已知L能发生银镜反应,下列说法正确的是
A.K的核磁共振氢谱有两组峰 B.L是乙醛
C.M完全水解可得到K和L D.反应物K与L的化学计量比是1∶1
12.离子化合物Na2O2和CaH2与水的反应分别为①2Na2O2+2H2O=4NaOH+O2↑;②CaH2+2H2O=4Ca(OH)2+2H2↑。下列说法正确的是
A.Na2O2、CaH2中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.Na2O2中阴、阳离子个数比为1:2,CaH2中阴、阳离子个数比为2:1
D.当反应①和②中转移的电子数相同时,产生的O2和H2的物质的量相同
13.一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或Mg(OH)Cl中的一种。下列说法正确的是
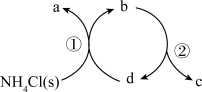
A.a、c分别是HCl、NH3
B.d既可以是MgO,也可以是Mg(OH)Cl
C.已知MgCl2为副产物,则通入水蒸气可减少MgCl2的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
14.利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:i.图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ii.2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(CO32-)=Ksp(MgCO3) [注:起始c(Na2CO3)=0.1mol·L-1,不同pH下c(CO32-)由图1得到]。
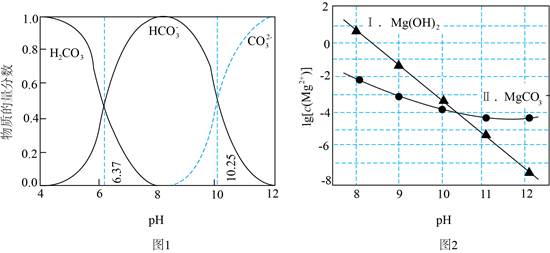
下列说法不正确的是
A.由图1,pH=10.25,c(HCO3-)=c(CO32-)
B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在
c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2HCO3-=MgCO3↓+CO2↑H2O
15.硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S2O32-)可看作是SO42-中的一个O原子被S原子取代的产物。
(1)基态S原子价层电子排布式是__________。
(2)比较S原子和O原子的第一电离能大小,从原子结构的角度说明理由:____________________。
(3)S2O32-的空间结构是__________。
(4)同位素示踪实验可证实S2O32-中两个S原子的化学环境不同,实验过程为
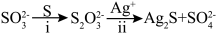 。过程ⅱ中,S2O32-断裂的只有硫硫键,若过程ⅰ所用试剂是Na232SO3和35S,过程ⅱ含硫产物是__________。
。过程ⅱ中,S2O32-断裂的只有硫硫键,若过程ⅰ所用试剂是Na232SO3和35S,过程ⅱ含硫产物是__________。(5)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
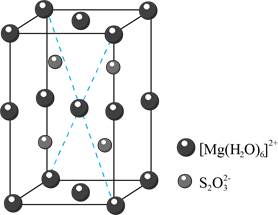
晶胞中的[Mg(H2O)6]2+个数为__________。已知MgS2O3·6H2O的摩尔质量是Mg·mol-1,阿伏加德罗常数为NA,该晶体的密度为__________g·cm-3。(1nm=10-7cm)
(6)浸金时,S2O32-作为配体可提供孤电子对与Au+形成[Au(S2O3)2]3-。分别判断S2O32-中的中心S原子和端基S原子能否做配位原子并说明理由:____________________。
16.尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是____________________。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.CO2和NH3生成NH2COONH4;
ⅱ.NH2COONH4分解生成尿素。
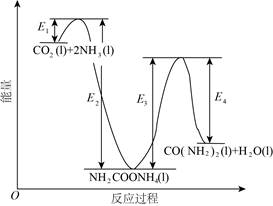
结合反应过程中能量变化示意图,下列说法正确的是__________(填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.CO2(l)+2NH3(l)=CO(NH2)2(l)+H2O(l) ΔH=E1-E2
(3)近年研究发现,电催化CO2和含氮物质(NO3-等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的KNO3溶液通CO2至饱和,在电极上反应生成CO(NH2)2,电解原理如图所示。
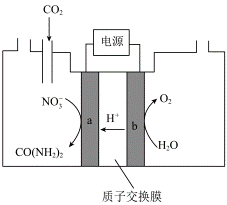
①电极b是电解池的__________极。
②电解过程中生成尿素的电极反应式是_____________。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中c(NH4+)不能直接用NaOH溶液准确滴定。

①消化液中的含氮粒子是__________。
②步骤ⅳ中标准NaOH溶液的浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有__________。
17.化合物P是合成抗病毒药物普拉那韦的原料,其合成路线如下。

已知:
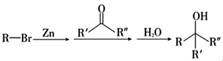
(1)A中含有羧基,A→B的化学方程式是____________________。
(2)D中含有的官能团是__________。
(3)关于D→E的反应:
①
 的羰基相邻碳原子上的C-H键极性强,易断裂,原因是____________________。
的羰基相邻碳原子上的C-H键极性强,易断裂,原因是____________________。②该条件下还可能生成一种副产物,与E互为同分异构体。该副产物的结构简式是__________。
(4)下列说法正确的是__________(填序号)。
a.F存在顺反异构体
b.J和K互为同系物
c.在加热和Cu催化条件下,J不能被O2氧化
(5)L分子中含有两个六元环。L的结构简式是__________。
(6)已知:
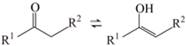 ,依据D→E的原理,L和M反应得到了P。M的结构简式是__________。
,依据D→E的原理,L和M反应得到了P。M的结构简式是__________。18.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
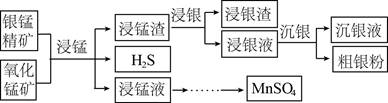
已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出:矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应MnS+2H+=Mn2++H2S↑,则可推断:Ksp(MnS) __________(填“>”或“<”)Ksp(Ag2S)。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有__________。
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
①将“浸银”反应的离子方程式补充完整:__________。
Fe3++Ag2S+
 +2[AgCl2]-+S
+2[AgCl2]-+S②结合平衡移动原理,解释浸出剂中Cl-、H+的作用:____________________。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
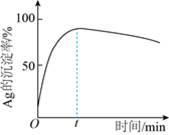
①该步反应的离子方程式有______________________________。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:______________。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:________。
19.资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I-=I3-(红棕色);I2和I3-氧化性几乎相同。
I.将等体积的KI溶液加入到m mol铜粉和n mol I2(n>m)的固体混合物中,振荡。
实验记录如下:
| c(KI) | 实验现象 | |
| 实验Ⅰ | 0.01mol·L-1 | 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1mol·L-1 | 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4mol·L-1 | I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是_____________________。
ⅱ.查阅资料,2Cu2++4I-=2CuI↑+I2,[Cu(H2O)4]2+(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化:______________。
(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是____________________。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,__________(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是____________________。
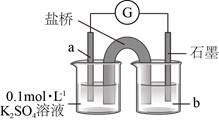
(4)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是_____________。
(5)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因:_________。