A.使用明矾对水进行净化 B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热 D.荧光指示牌被照发光
2.下列反应得到相同的产物,相关叙述错误的是
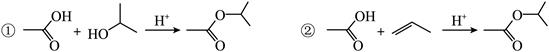
A.①的反应类型为取代反应 B.反应②是合成酯的方法之一
C.产物分子中所有碳原子共平面 D.产物的化学名称是乙酸异丙酯
3.下列装置可以用于相应实验的是
| A | B | C | D |
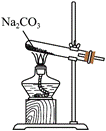 | 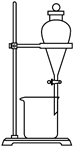 | 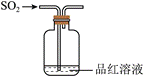 | 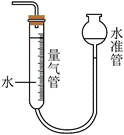 |
| 制备CO2 | 分离乙醇和乙酸 | 验证SO2酸性 | 测量O2体积 |
4.一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是
A.X的常见化合价有-1、-2 B.原子半径大小为Y>X>W
C.YX的水合物具有两性 D.W单质只有4种同素异形体
5.一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是
| A | 硫酸亚铁溶液出现棕黄色沉淀 | 6FeSO4+O2+2H2O=2Fe2(SO4)3+2Fe(OH)2↓ |
| B | 硫化钠溶液出现浑浊颜色变深 | Na2S+2O2=Na2SO4 |
| C | 溴水颜色逐渐褪去 | 4Br2+4H2O=HBrO4+7HBr |
| D | 胆矾表面出现白色粉末 | CuSO4∙5H2O=CuSO4+5H2O |
6.室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。工作时,在硫电极发生反应:
 S8+e-→
S8+e-→ S82-,
S82-, S82-+e-→S42-,2Na++
S82-+e-→S42-,2Na++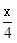 S42-+2(1-
S42-+2(1-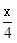 )e-→Na2Sx
)e-→Na2Sx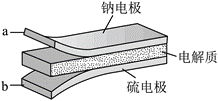
下列叙述错误的是
A.充电时Na+从钠电极向硫电极迁移
B.放电时外电路电子流动的方向是a→b
C.放电时正极反应为:2Na++
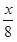 S8+2e-→Na2Sx
S8+2e-→Na2SxD.炭化纤维素纸的作用是增强硫电极导电性能
7.一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。

下列说法正确的是
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
B.b点时,c(Cl-)=c(CrO42-),Ksp(AgCl)=Ksp(Ag2CrO4)
C.Ag2CrO4+2Cl-
 2AgCl+CrO42-的平衡常数K=107.9
2AgCl+CrO42-的平衡常数K=107.9D.向NaCl、Na2CrO4均为0.1mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
8.元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。

回答下列问题:
(1)将装有样品的Pt坩埚和CuO放入石英管中,先_______,而后将已称重的U型管c、d与石英管连接,检查_______。依次点燃煤气灯_______,进行实验。
(2)O2的作用有_______。CuO的作用是_______(举1例,用化学方程式表示)。
(3)c和d中的试剂分别是_______、_______(填标号)。c和d中的试剂不可调换,理由是_______。
A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)Pt坩埚中样品CxHyOz反应完全后,应进行操作:_______ 取下c和d管称重。
(5)若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为_______。
9.LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:

已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为_______。为提高溶矿速率,可采取的措施_______(举1例)。
(2)加入少量MnO2的作用是_______。不宜使用H2O2替代MnO2,原因是_______。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_______mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是_______。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有_______。
(5)在电解槽中,发生电解反应的离子方程式为_______。随着电解反应进行,为保持电解液成分稳定,应不断_______。电解废液可在反应器中循环利用。
(6)缎烧窑中,生成LiMn2O4反应的化学方程式是_______。
10.硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)在N2气氛中,FeSO4∙7H2O的脱水热分解过程如图所示:

根据上述实验结果,可知x=_______,y=_______。
(2)已知下列热化学方程式:
FeSO4∙7H2O(s)=FeSO4 (s)+7 H2O(g) ΔH1=akJ·mol-1
FeSO4∙xH2O(s)=FeSO4 (s)+xH2O(g) ΔH2=bkJ·mol-1
FeSO4∙yH2O(s)=FeSO4 (s)+yH2O(g) ΔH2=ckJ·mol-1
则FeSO4∙7H2O(s) + FeSO4∙yH2O(s)=2(FeSO4∙xH2O) (s))的ΔH= kJ·mol-1
(3)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:
FeSO4(s)
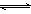 Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时P(SO3)-T的关系如下图所示。600K时,该反应的平衡总压P(总)_______kPa、平衡常数Kp(I) Kp(I)=_______(kPa)2。Kp(I)随反应温度升高而_______(填“增大”“减小”或“不变”)。
Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时P(SO3)-T的关系如下图所示。600K时,该反应的平衡总压P(总)_______kPa、平衡常数Kp(I) Kp(I)=_______(kPa)2。Kp(I)随反应温度升高而_______(填“增大”“减小”或“不变”)。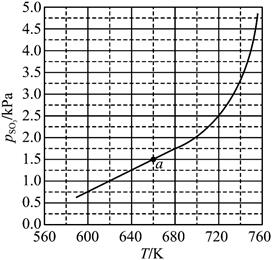
(4)提高温度,上述容器中进一步发生反应2SO3(g)
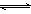 2SO2(g)+O2(g)(Ⅱ),平衡时P(O2)=_______(用P(SO3)、P(SO2)表示)。在929K时,P(总)=84.6kPa、P(SO3)=35.7kPa,则P(SO2)=_______kPa,Kp(II)=_______kPa(列出计算式)。
2SO2(g)+O2(g)(Ⅱ),平衡时P(O2)=_______(用P(SO3)、P(SO2)表示)。在929K时,P(总)=84.6kPa、P(SO3)=35.7kPa,则P(SO2)=_______kPa,Kp(II)=_______kPa(列出计算式)。11.中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为_______。橄榄石中,各元素电负性大小顺序为_______,铁的化合价为_______。
(2)已知一些物质的熔点数据如下表:
| 物质 | 熔点/℃ |
| NaCl | 800.7 |
| SiCl4 | -68.8 |
| GeCl4 | -51.5 |
| SnCl4 | -34.1 |
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有_______个Mg。该物质化学式为_______,B-B最近距离为_______。
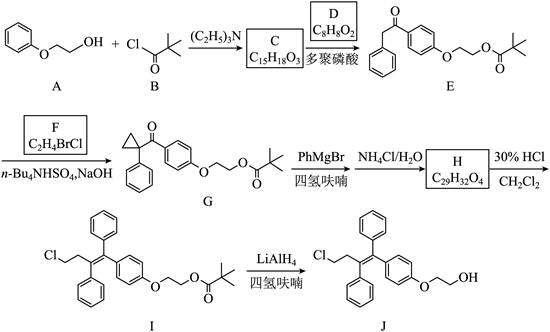
12.奥培米芬(化合物J)是一种雌激素受体调节剂,以下是一种合成路线(部分反应条件己简化)。
已知:
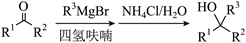
回答下列问题:
(1)A中含氧官能团的名称是_______。
(2)C的结构简式为_______。
(3)D的化学名称为_______。
(4)F的核磁共振谱显示为两组峰,峰面积比为1∶1,其结构简式为_______。
(5)H的结构简式为_______。
(6)由I生成J的反应类型是_______。
(7)在D的同分异构体中,同时满足下列条件的共有_______种;
①能发生银镜反应;②遇FeCl3溶液显紫色;③含有苯环。
其中,核磁共振氢谱显示为五组峰、且峰面积比为2∶2∶2∶1∶1的同分异构体的结构简式为_______。