A.H2O2具有还原性,可用作丝织品的漂白剂
B.BaCO3能与盐酸反应,可用作胃酸的中和剂
C.碳的非金属性强于硅,可用作工业上制粗硅
D.FeCl3溶液具有氧化性,可用作铜制线路板的蚀刻液
2.某同学取海带灰加蒸馏水煮沸2~3 min,冷却,过滤,获得含I−的溶液,并设计以下实验方案,从中提取I2。

下列说法中错误的是
A.试剂b可能是CCl4 B. “I2的悬浊液→粗碘”需萃取
C.“下层溶液”可在流程中循环利用 D.反应1、反应2、反应3都是氧化还原反应
3.化合物(a)
 、(b)
、(b) 、(c)
、(c)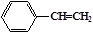 ,(d)
,(d)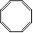 ,下列说法不正确的是
,下列说法不正确的是A.a、b、c、d互为同分异构体 B.除a外均可发生加成反应
C.c中所有原子不可能处于同一平面 D.一氯代物同分异构体最多的是c
4.设NA为阿伏加德罗常数的值,下列说法不正确的是(Na-23 C-12 O-16 Fe-56)
A.8.4gNaHCO3晶体中离子总数为0.2NA
B.12g金刚石中含有的共价键数为2NA
C.pH=13的NaOH溶液中含有的OH-数目为0.1NA
D.5.6gFe与过量的氯气充分反应转移的电子总数为0.3NA
5.短周期主族元素X、Y、Z、W原子序数依次增大,X、Y、Z的最外层电子数之和与W的最外层电子数相等,X的最高正价为+4,Y是海水中含量最多的金属元素。下列说法不正确的是
A.原子半径:r(Y)>r(Z)>r(X)
B.W的氢化物的稳定性比X的最简单氢化物的稳定性弱
C.W分别与Y、Z形成的化合物所含的化学键类型相同
D.Y的最高价氧化物对应的水化物碱性比Z的强
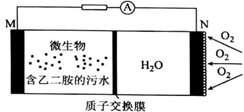
6.实验室可利用下列微生物电池将污水中的乙二胺[H2N(CH2)2NH2]转化为无毒无害的物质并产生电能(M、N均为石墨电极)。有关该电池工作时的说法中错误的是
A.M极的电势比N极的电势低
B.正极电极反应式:O2+4e-+4H+=2H2O
C.电池总反应为:H2N(CH2)2NH2+ 4O2=N2 + 2CO2 +4H2O
D.每消耗5.6升O2时,通过质子交换膜的质子数为NA
7.常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:

⑴“破碎”的目的是_______________________________________。
⑵操作a和操作b的名称分别是_________、___________。
⑶操作a用到的玻璃仪器有玻璃棒、_____________________。
⑷操作a所用青蒿必须干燥且不宜加热,原因是_______________________________。
Ⅱ.燃烧法测定最简式:
实验室用下图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。
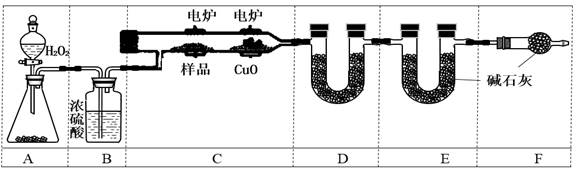
⑸实验前至少称量_________个质量数据。
⑹装置D中所盛固体可以是____(用对应符号填空);(a.生石灰b.CaCl2 c.CuSO4 d.碱石灰)
F的作用是________________ _______。
⑺A中固体分别用MnO2、KMnO4时产生等量O2,消耗H2O2的物质的量之比为______。(生成的O2全部放出,与KMnO4反应的H2O2经过酸化)
⑻燃烧m g青蒿素,图中D、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________________(只写计算式,用含有m、a、b的符号来表示,不化简)。
8.能源开发、环境保护、资源利用等是化学应用的重要方向。回答下列问题:
⑴催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H1=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H2=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H3=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H =________________。
⑵CO2可通过反应CO2(g)+CH4(g)
 2CO(g)+2H2(g)来制取H2。在1.0L密闭容器中充入CO2、CH4各1mol,发生上述反应,测得CH4的平衡转化率与温度压强的关系如图a所示
2CO(g)+2H2(g)来制取H2。在1.0L密闭容器中充入CO2、CH4各1mol,发生上述反应,测得CH4的平衡转化率与温度压强的关系如图a所示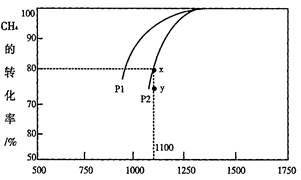
① 由图a可知,压强P1______P2(填“大于”或“小于”),该反应的△H_______0(填“大于”或“小于”)
② 当压强为P2时,y点的υ(正)____ υ(逆) (填“大于”、“小于”或“=”);y点对应温度下,该反应的平衡常数K=___________(保留四位有效数字)。
③ 实验表明,温度高于1250℃时,容器中c(CO2)>c(CH4),请结合两种反应物的性质分析可能的原因:_______________________________________________。
⑶
 汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。
汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。① 请写出负极反应式:_______________________,②该仪器工作时,O2-移向_______极(填写a或b)。
9.我国科学家研制的第二代“彩虹鱼”万米级深海着陆器所用的金属材料主要是钛合金。以钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)为主要原料制钛的流程如下:

已知:①钛在常温下不与强酸、强碱反应;
②Ti4+易水解生成TiO2+, TiO2+进一步水解可得H2TiO3。
⑴ “废气”中含有少量空气污染物,其分子式为________。
⑵ “150-200℃溶煮”时生成Ti(SO4)2和TiOSO4且有气体产生,写出生成TiOSO4反应的化学方程式_______________________________________________。
⑶ 沉淀池中加入Fe时,开始无气泡,溶液由棕黄色变浅绿色,片刻后有无色无味气体产生。写出Fe参与的离子反应方程式____________________________。
⑷ 已知FeSO4在水中的溶解度曲线如图所示,由此可知在沉淀池由溶液获得目标物质的方法是______________。
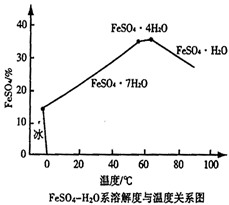
⑸ “加热煮沸”操作的主要目的是_____________。
⑹ 简述“精炼”阶段,从Ti、Mg混合物获得Ti的实验方案是_____________________________。