A.月饼因富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
B.将草木灰与NH4 H2PO4混合施用可更好地为植物全面提供N、P、K三种营养元素
C.金刚砂和氧化铝透明陶瓷都属于无机非金属材料
D.绚丽缤纷的烟花中添加了含铁、铂、钾、钠、铜等金属化合物
2.若用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 2.4g镁在足量的O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6LCO2气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的电子数为1.6NA
D. 0.1L0.5mol/L CH3COOH溶液中含有的H+数为0.05NA
3.下列有关物质的性质与用途具有对应关系的是
A.MgO、Al2O3熔点高,均可用作耐高温材料
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.SO2具有氧化性,可用于漂白纸浆
4.下列指定反应的离子方程式书写正确的是
A.将铜插入稀硝酸中:Cu+4H++2NO3− = Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe = 2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O = Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+ = H2SiO3↓+2Na+
5.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如下图所示,下列说法不正确的是
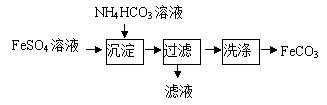
A.产品FeCO3在空气中高温分解可得到纯净的FeO
B.沉淀过程中有CO2气体放出
C.过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D.可利用KSCN溶液检验FeSO4溶液是否变质
6.常温下,下列说法不正确的是
A.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1∶10
B.0.1 mol·L-1的CH3COOH溶液中,由水电离的c(H+)为1×10-13mol·L-1
C.等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后溶液的pH<7
D.等体积pH=2的H2SO4溶液和pH=2的CH3COOH溶液混合后溶液的pH=2
7.右图装置中发生反应的离子方程式为:Zn+2H+ = Zn2++H2↑,下列说法不正确的是
A.a,b不可能是同种材料的电极
B.该装置可能是电解池,电解质溶液为稀盐酸
C.该装置可能是原电池,电解质溶液为稀盐酸
D.该装置可看作是铜-锌原电池,电解质溶液为稀硫酸

8.在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为 1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
A.该反应的ΔH>0、T1<T2
B.T2时CH4的平衡转化率为30.0%
C.T2时40min后,断裂4mol C-H键同时断裂4 mol O-H键
D.T1时向平衡体系中再充入CH4,建立平衡后CO2的体积分数一定增大
9.常温下,下列说法不正确的是( )
A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO)>c(OH-)>c(H+)
B.叠氮酸(HN3)与醋酸酸性相近,0.1 mol·L-1NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N)>c(OH-)>c(H+)
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH)=c(Cl-)
D.0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:
2c(OH-) + c(C2O42-) = c(HC2O4-) + 2c(H+)
10.下列图示与对应的叙述相符的是
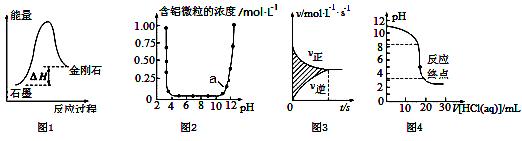
A.图1所示,从能量角度考虑,石墨比金刚石稳定
B.图2表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
C.图3所示,图中的阴影部分面积的含义是(v正-v逆)
D.图4表示0.001 mol·L-1盐酸滴定0.001 mol·L-1NaOH溶液的滴定曲线
11.下列实验操作能达到实验目的的是
| 实验目的 | 实验操作 | |
| A | 制备Fe(OH)3胶体 | 将NaOH稀溶液滴加到饱和的FeCl3溶液中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 证明非金属性:Cl>C>Si | 将盐酸与石灰石反应产生的气体通入硅酸钠溶液 |
| D | 除去Cu粉中混有的CuO | 加入稀硫酸,过滤、洗涤、干燥 |
12.某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1 mol·L-1。某同学进行了如下实验:

下列说法正确的是( )
A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.无法确定沉淀C的成分
D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
13.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
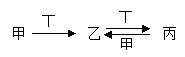
下列有关物质的推断不正确的是( )
A.若甲为AlCl3溶液,则丁可能是NaOH溶液
B.若甲为氮气,则丁可能是O2
C.若甲为Fe,则丁可能是稀硝酸
D.若甲为NaOH溶液,则丁可能是CO2
14.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是
A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为:2NH3-6e-+6OH- = N2+6H2O

15.磁性材料A由两种元素组成,取2.960gA在足量的空气中充分煅烧,得到 2.400g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强。请回答下列问题:
(1)A的组成元素为_________(用元素符号表示)。
(2)溶液C也可用于处理污水,用离子方程式表示污水处理原理____________。
(3)已知化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,写出该反应的化学方程式____________________________。
(4)结合离子方程式解释E中加足量碘的碘化钾溶液后溶液酸性增强的原因 。
16.在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接____;____接___;b接_____(填接口编号)。
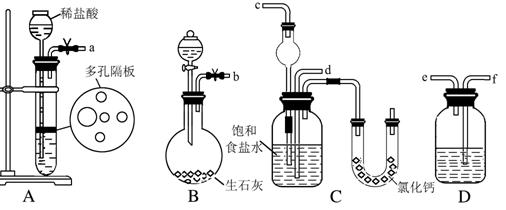
(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让_______装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是__________________________________________;装有无水CaCl2的U形管的作用是______________________________________________________。
(5)第三步分离出NaHCO3固体的操作是___________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH 4C1。简要写出操作和现象_________________________________________________________________________。
17.锌锰电池(俗称干电池)在生活中的用量很大。其中普通锌锰电池的构造图如右图所示。
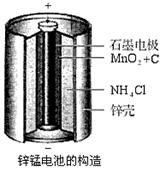
回答下列问题:
(1)电池放电时发生的主要反应为: Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,正极发生的主要反应是_________________________。
(2)下图表示从废旧普通锌锰电池除去锌壳和电极后的内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①黑色固体混合物水浸时为提高浸出速率,常采用的措施为___________________(答两条);得到滤液加入稀盐酸的作用为___________________________________________。
②滤渣水洗灼烧后固体主要成份只有一种,操作a中得到熔块的主要成分是K2MnO4,该过程中发生反应的化学方程式为:__________________________________________。
③图中产物的化学式分别为:A_______、B_______。
(3)准确称量得到的KMnO4(不含能与草酸反应的杂质) 3.160 g,放入小烧杯中,加水溶解后转移到200mL容量瓶中定容,在锥形瓶中用差量法称取 0.6700 g无水草酸钠,加入足量硫酸溶液溶解,加热至75~80℃。用已配制好的KMnO4溶液进行滴定,消耗溶液体积为22.50mL。
已知Mr(Na 2C2O4)=134 Mr(KMnO4)=158
①判断滴定终点的现象是_______________________________________________________。
②KMnO4的纯度为__________。
18.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及如下反应。
甲醇合成反应: (i)CO(g) + 2H2(g)
 CH3OH(g) △H1= -90.1 kJ•mol-1
CH3OH(g) △H1= -90.1 kJ•mol-1二甲醚合成反应:(ii)2CH3OH(g)
 CH3OCH3(g) + H2O(g) △H2 = -23.9 kJ•mol-1
CH3OCH3(g) + H2O(g) △H2 = -23.9 kJ•mol-1(iii)2CH3OH(g)
 C2H4(g)+2H2O(g) △H3 = -29.1 kJ•mol-1
C2H4(g)+2H2O(g) △H3 = -29.1 kJ•mol-1回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上以铝土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示) 、 、2Al(OH)3
 Al2O3 +3H2O。
Al2O3 +3H2O。(2)一定温度时,反应(i)的平衡常数数值Kp = 4.80×10-2,向容器中充入2 mol H2和1 molCO,反应(i)达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为__________ (Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(3)二甲醚合成反应过程中两反应能量变化如图所示:

①反应速率较大的是______(填序号“ ii”、“ iii”),说明原因 。
②若在容器中加入催化剂,则E2 - E1将__________(填“变大”、“不变”或“变小”)。
(4)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
19.铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是 ,铜的基态原子核外电子排布式为 ,元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃, 100℃以上升华,沸点 249℃。据此判断二茂铁晶体类型为_________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
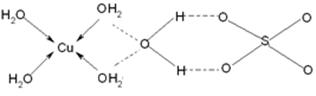
图中虚线表示________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是______;O原子的价电子排布图为__________________。
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为 。
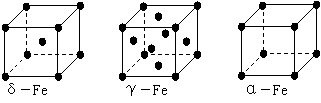
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_____。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为 。

20.某药物H的合成路线如下:
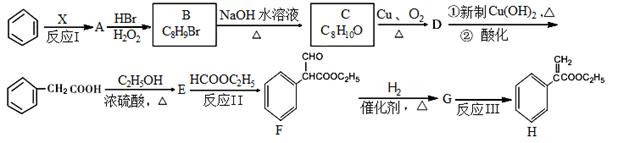
试回答下列问题:
(1)反应Ⅰ所涉及的物质均为烃,氢的质量分数均相同,则X的结构式为 ,A的名称为 。
(2)反应Ⅱ的反应类型是 。
(3)B的结构简式是 ;E的分子式为 ;F中含氧官能团的名称是 。
(4)由C→D反应的化学方程式为 。
由G→H反应的化学方程式为 。
(5)化合物G酸性条件下水解产物之一M有多种异构体,满足下列条件的结构有 种。
①能发生水解反应和银镜反应;②能与FeCl3发生显色反应;③苯环上只有两个取代基。