(2)①平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可)
②2NH3(g)+CO2(g)===H2NCOOONH4(s) ΔH=-159.90kJ·mol−1
吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可)
③(NH4)2CO3(或NH4HCO3)
2.(1)d→e→b→c→f(或g)→g(或f)→i
(2)排除装置中的空气,防止NO被氧化为NO2
(3)碱石灰或无水氯化钙 将NO2转化为NO
(4)5NO+3MnO+4H+===5NO+3Mn2++2H2O
(5)溶液由无色变为紫色(或紫红色),且半分钟不褪色
(6)c
(7)34.5b/a×100%
3.(1)③中导管改为长进短出,④中试管口加一出气导管或加一个防水蒸气进入和尾气处理装置
(2)MnO2+4H++2Cl−Mn2++Cl2↑+2H2O
(3)a→hi→fg→de→b A
(4)防止反应结束后空气中的水蒸气进入D装置中使无水FeCl3潮解,吸收尾气,防止氧气污染空气
(5)如果拆去E和F装置,可能会发生反应Fe+2HCl===FeCl2+H2↑,在C中加热氢气与氯气的混合气体,易发生爆炸
(6)取少量样品于表面皿中,用磁铁把铁吸出,取剩余的固体于试管水中,加蒸馏水溶解,向其中滴入K3[Fe(CN)6]溶液,溶液中无明显现象,说明产品中没有FeCl2
4.(1)防止可能生成的NO被完全氧化成NO2,造成对A中反应气体产物检验不完全
(2)无尾气吸收装置
(3)C中出现红棕色气体 冷凝使NO2完全液化
(4)2NaNO2+H2SO4===Na2SO4+NO2↑+NO↑+H2O
(5)NaClO+CO(NH2)2+2NaOH===N2H4·H2O+Na2CO3+NaCl
2N2H4 +2NO2===3N2+4H2O
5.(1)B
(2)重复上述a~d步骤,直至A恒重 将装置A中的水蒸气带走;同时防止FeC2O4被空气氧化
(3)C→E→C→F→G→C→H G装置黑色固体变红,其后的C中澄清石灰水变浑浊 3FeC2O4Fe3O4+4CO↑+2CO2↑
6.(1)除去粗硅中SiO2、Fe2O3、CuO等杂质
(2)a、b SiHCl3+H2
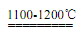 Si+3HCl
Si+3HCl (3)加热SiHCl3,以便使之变成蒸汽进入石英管 反应温度较高,普通玻璃不能承受该高温
(4)没有进行尾气处理
(5)蒸馏
(6)使用了有毒气体;三氯氢硅氢还原法中HCl和H2可以直接循环利用,节约了成本,而四氯化硅氢还原法中没有可循环利用的原料
7.(1)检验产物中是否有水生成
(2)SO2 SO2+H2O2+Ba2+===BaSO4↓+2H+ 否 若有SO3也有白色沉淀生成
(3)步骤:取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液(或:依次滴加K3Fe(CN)6溶液、KSCN溶液或其他合理答案) 现象:若高锰酸钾溶液不褪色,加入KSCN溶液后变红(或:加入K3Fe(CN)6溶液无现象,加入KSCN溶液后变红,或其他合理答案)
(4)3x+y=z
(5)2(NH4)2Fe(SO4)2Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O
8.(1)Al4C3+12HCl===3CH4↑+4AlCl3
(2)F→D→B→E→C→G
(3)先打开分液漏斗上口的玻璃塞(或先使分液漏斗上口的玻璃塞的凹槽对准漏斗上的小孔),再将分液漏斗下面的旋塞打开,使稀盐酸缓慢滴下试管内
(4)有黑色固体生成(或试管内有银镜生成) 除去甲烷中的HCl气体和水蒸气
(5)取少量红色固体,加入适量稀硫酸,若溶液变为蓝色,则证明红色固体中含有Cu2O取少量Cu2O固体于试管中,加入适量0.1mol·L−1AgNO3溶液
9.(1)2Na2O2+2H2O===4NaOH+O2↑ 使生成的SO2全部被H2O2溶液吸收
(2)防止倒吸 SO2+H2O2===H2SO4
(3)250mL容量瓶、胶头滴管 当加入最后一滴NaOH溶液时,溶液变为浅红色且30秒内不褪色
(4)Cu2S
(5)不合理。部分SO2被氧化,且空气中的CO2和水蒸气可能使干燥管增重