 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 北京市西城区2021届高三(4月)统一测试化学试题 | |
|---|---|
| 本卷共有试题:10 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | 元素周期律的发现是近代化学史上的一座里程碑。下列事实不能用元素周期律解释的是 A. Na2CO3溶液中加盐酸,产生气泡 B.常温下,形状和大小相同的Mg、Al与同浓度盐酸反应,Mg条更剧烈 C.气态氢化物的稳定性:H2O>H2S D. Cl2从NaBr溶液中置换出Br2 |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | 某小组用如图装置探究SO2的性质。下列离子方程式书写不正确的是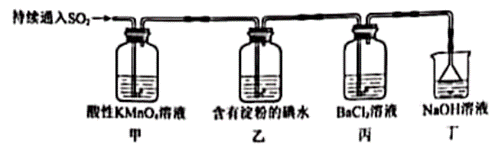 A.甲中紫色褪去:5SO2+2MnO4-+2H2O=2Mn2++5SO52-+4H+ B.乙中蓝色逐渐变浅:I2+SO2+2H2O=2I-+SO42-+4H+ C.丙中产生少量白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+ D.丁中可能的反应:SO2+2OH-=SO32-+H2O |
|||
答案 |
C | |||
| 题号 | 3 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | 新鲜水果和蔬菜中富含维生素C,在I2作用下可转化为脱氢维生素C,原理如图:  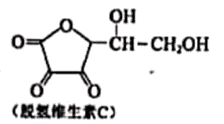 下列关于维生素C的说法正确的是 A.分子式为C6H7O6 B.难溶于水,易溶于有机溶剂 C.与脱氢维生素C都可使酸性KMnO4溶液褪色 D.与脱氢维生素C互为同分异构体 |
|||
答案 |
C | |||
| 题号 | 4 |
|
||||||||||||
出处 |
2021北京西城4月 | |||||||||||||
| 题干 | 下列实验方案能达到相应目的的是
|
|||||||||||||
答案 |
C |
|||||||||||||
| 题号 | 5 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | Claiscn重排反应是有机合成中常用的重要反应。以CH2=CHOCH2CH=CH2为例,其反应过程对应的机理有两种,如图(“-”可表示单,双键),下列说法不正确的是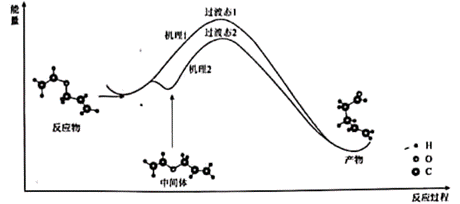 A.机理1:反应物→产物的过程中,有极性共价键断裂 B.机理2:反应物→中间体的过程中,没有化学键断裂,只有空间结构变化 C.该反应的化学方程式:CH2=CHOCH2CH=CH2→CH2=CHCH2CH2CHO D.相比于机理1,机理2所需活化能降低,活化分子百分比下降,反应速率减慢 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | 一种新型高分子M的合成方法如图: 下列说法不正确的是 A.酪氨酸能与酸、碱反应生成盐 B. 1mol环二肽最多能与2molNaOH反应 C.高分子M中含有 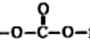 结构片断 结构片断D.高分子M在环境中可降解为小分子 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | 利用废铝箔(主要成分为Al,含少量Mg、Fe等)制明矾[KAl(SO4)2·12H2O]的一种工艺流程如图: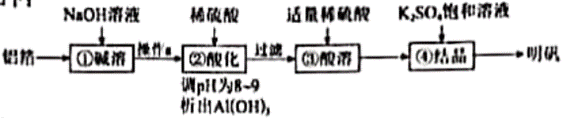 下列说法不正确的是 A. ①中生成了H2:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ B.操作a是过滤,以除去难溶于NaOH溶液的杂质 C. ②③中加入稀硫酸的作用均是除去杂质 D.由④可知,室温下明矾的溶解度小于Al2(SO4)3和K2SO4的溶解度 |
|||
答案 |
C | |||
| 题号 | 8 |
|
||
出处 |
2021北京西城4月 | |||
| 题干 | 相同温度和压强下,研究Cl2在不同溶液中的溶解度(用溶解Cl2的物质的量浓度表示)随溶液浓度的变化。在NaCl溶液和盐酸中Cl2的溶解度以及各种含氯微粒的浓度变化如图。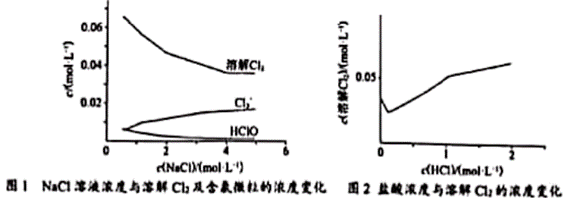 下列说法不正确的是 A.由图1可知,Cl2溶于NaCl溶液时还发生了反应Cl2+Cl-  Cl3- Cl3-B.随NaCl溶液浓度增大,Cl2+H2O  H++Cl-+HClO平衡逆移,Cl2溶解度减小 H++Cl-+HClO平衡逆移,Cl2溶解度减小C.随盐酸浓度增加Cl2与H2O的反应被抑制,生成Cl3-为主要反应从而促进Cl2溶解 D.由上述实验可知,H+浓度增大促进Cl2溶解,由此推知在稀硫酸中,随硫酸浓度增大Cl2的溶解度会增大 |
|||
答案 |
D | |||
| 题号 | 9 |
|
||||||||||
出处 |
2021北京西城4月 | |||||||||||
| 题干 | 海水中的化学资源具有巨大的开发潜力。 (1)溴及其化合物广泛用于医药、塑料阻燃剂等。苦卤(含Br-)提溴的工业流程如图: 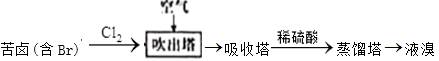 ①向吹出塔中通空气的目的是_______。 ②吸收塔中盛有Na2CO3溶液,通入足量Br2蒸气时,有BrO3-和无色气体生成,反应的离子方程式是_______。 (2)用如图所示装置(  表示斜发沸石)分离海水中的K+和Na+,料液(含K+、Na+、Cl-和I-)先流过斜发沸石吸附K+和I-。然后通电,双极膜产生的H+将K+交换下来,OH-将I-交换下来,得到A溶液。 表示斜发沸石)分离海水中的K+和Na+,料液(含K+、Na+、Cl-和I-)先流过斜发沸石吸附K+和I-。然后通电,双极膜产生的H+将K+交换下来,OH-将I-交换下来,得到A溶液。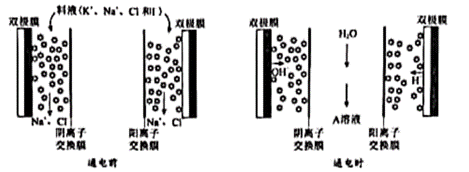 ①简述A溶液中含K+不含Na+的原因:_______。 ②海水中c(K+)>c(I-),则A溶液中的溶质是_______。为了提高产率并防止原料浪费,通电一段时间后,将阴、阳极的斜发沸石对调,继续通电,此时斜发沸石内主要反应的离子方程式是_______。 (3)KI广泛用于皮肤科、眼科等疾病的治疗。利用海水中获得的I2和(2)中获得的A溶液及Fe粉,可获得纯度较高的KI晶体,流程如图:  已知:i. KI的溶解度
①用化学方程式说明加入Fe粉的作用:_______。 ②操作1是_______,过滤,洗涤,干燥。 |
|||||||||||
答案 |
(1) ①将Br2蒸气吹出 ②3Br2+3CO32-=5Br-+BrO3-+3CO2 (2)①料液(含K+、Na+、Cl-和I-)先流过斜方沸石,K+被吸附,与Na+分离,Na+随溶液流出,然后通电,双极膜产生的H+将K+交换下来,K+通过阳离子交换膜进入H2O中 ②KI、KOH H++OH-=H2O (3)①KIO3+3Fe+3H2O=KI+3Fe(OH)2 ②加热浓缩,降温结晶 |
|||||||||||
| 题号 | 10 |
|
||||||||||||||||||
出处 |
2021北京西城4月 | |||||||||||||||||||
| 题干 | 某小组同学根据Fe3+、Fe2+和Zn2+的氧化性推斯溶液中Zn与Fe3+可能先后发生两个反应:2Fe3++Zn=2Fe2++Zn2+,Fe2++ Zn= Zn2++ Fe,进行如下实验。
(2)结合化学用语解释实验Ⅱ中产生红褐色浑浊的原因:_______。 (3)实验Ⅲ,用Fe2(SO4)3溶液和Fe(NO3)3溶液替代实验Ⅱ中的FeCl3溶液:
 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。 [Fe(NO)]2+,[Fe(NO)]2+在溶液中呈棕色。①a=_______。 ②有人认为Ⅰ中深棕色溶液中存在[Fe(NO)]2+,设计实验证明。实验的操作和现象是_______。 ③对照实验Ⅱ和Ⅲ,Fe(NO3)3溶液与过量锌粉反应没有生成铁的原因是_______。 (4)实验Ⅳ:将实验Ⅱ中FeCl3水溶液换成FeCl3无水乙醇溶液,加入足量锌粉,刻后,反应放热,有大量铁产生。由实验Ⅰ~Ⅳ可知:锌能否与Fe3+反应得到单质铁,与Zn和Fe3+的物质的量、Fe3+的浓度、_______、_______等有关。 |
|||||||||||||||||||
答案 |
(1) 蓝色沉淀 (2)Fe3++3H2O  Fe(OH)3+3H+,H+被消耗,促进Fe3+的水解,产生氢氧化铁沉淀 Fe(OH)3+3H+,H+被消耗,促进Fe3+的水解,产生氢氧化铁沉淀 (3)①0.5 ②过滤,取少量深粽色溶液,加热,溶液粽色变浅,液面上方产生红粽色气体 ③ Fe2+与NO结合生成[Fe(NO)]2+,溶液中Fe2+的浓度下降,使得Fe2+与Zn反应的化学反应速率变慢 (4) 阴离子种类、溶剂 |
|||||||||||||||||||
| v福建省实践教学工作室 蔡实践 设计制作 v |