 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 海淀区2020~2021学年第一学期期末练习 | |
|---|---|
| 本卷共有试题:13 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 化学与生活息息相关,下列说法不正确的是( ) A.淀粉属于多糖 B.天然药物无毒副作用,可以长期服用 C.与铜质水龙头连接处的铁质水管更易被腐蚀 D.医疗垃圾有多种致病微生物,可用高温焚烧处理 |
|||
答案 |
B | |||
| 题号 | 2 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 甲烷燃料电池的工作原理如图,下列说法正确的是( )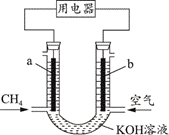 A.a极为正极 B.K+从a极经溶液流向b极 C.工作一段时间后,b极附近的pH会减小 D.a极的电极反应为CH4+6OH--8e-=CO32-+5H2O |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 下列化学用语对事实的表述不正确的是( ) A.工业上用乙醛催化氧化法制乙酸:2CH3CHO+O2  2CH3COOH 2CH3COOHB.向AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ C.用Na2S除去工业废水中的Hg2+:Hg2++S2-=HgS↓ D.电镀铜的阴极反应:Cu2++2e-=Cu |
|||
答案 |
B | |||
| 题号 | 4 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 2Na2S2O3+I2=2NaI+Na2S4O6是定量分析中的常用反应。下列关于说法不正确的是( ) A.反应中,I2表现了氧化性 B.反应中,每生成1 mol Na2S4O6,有4 mol e-发生转移 C.Na2S2O3是含有共价键的离子化合物 D.Na2S2O3在空气中放置会变质,产物可能有Na2SO4 |
|||
答案 |
B | |||
| 题号 | 5 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y的原子最外层只有1个电子,Z的单质晶体是应用最广泛的半导体材料。下列说法正确的是( ) A.原子半径:r(W)>r(Z)>r(Y)>r(X) B.Z的非金属性比X的强 C.由X、Y组成的化合物中可能含有共价键 D.Z的最高价氧化物对应的水化物的酸性比W的强 |
|||
答案 |
C | |||
| 题号 | 6 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A.由水电离的c(H+)=10−12mol∙L−1的溶液中:Na+、NH4+、Cl-、K+ B.无色溶液中:Na+、K+、Cr2O72-、NO3- C.含有I-的溶液中:H+、Na+、Cl-、NO3- D.pH=14的溶液中:K+、ClO-、CO32-、Cl- |
|||
答案 |
D | |||
| 题号 | 7 |
|
||||||||
出处 |
2021海淀期末 | |||||||||
| 题干 | 下列图示实验能达成相应目的的是( )
|
|||||||||
答案 |
D | |||||||||
| 题号 | 8 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | PCT树脂是应用广泛的一种高聚物,其结构简式为 ,它可由有机物X( ,它可由有机物X( )与另一种有机物Y反应制得。下列说法中不正确的是( ) )与另一种有机物Y反应制得。下列说法中不正确的是( )A.X可与H2发生加成反应生成Y B.Y的核磁共振氢谱有4组峰 C.X、Y生成PCT的反应属于缩聚反应 D.PCT制品应避免长时间与碱性物质接触 |
|||
答案 |
A | |||
| 题号 | 9 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 常温下,向20 mL0.1 mol/L的某一元酸(HA)溶液中加入几滴酚酞溶液,再逐滴滴加0.1 mol/LNaOH溶液,测得滴定曲线如图。下列说法不正确的是( )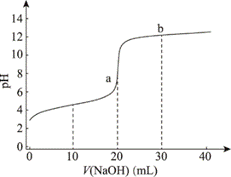 A.V=10 mL时,c(HA)>c(A-) B.pH=7时,V(NaOH)<20 mL C.滴定终点时,溶液由无色变为浅红色 D.a点的水的电离程度大于b点的水的电离程度 |
|||
答案 |
A | |||
| 题号 | 10 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 近期,天津大学化学团队以CO2与辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图。下列说法正确的是( )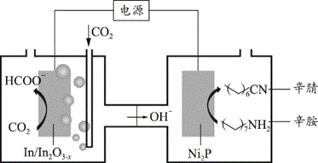 A.Ni2P电极与电源负极相连 B.辛胺转化为辛腈发生了还原反应 C.In/In2O3-x电极上可能有副产物H2生成 D.在In/In2O3-x电极上发生的反应为CO2+H2O-2e-=HCOO-+OH- |
|||
答案 |
C | |||
| 题号 | 11 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图1,反应过程中不同态物质体系所含的能量如图2。下列说法不正确的是( ) A.总反应焓变ΔH<0 B.由状态②到状③发生的是氧化还原反应 C.状态③到状态④的变化过程中有O—H键的形成 D.该脱硝过程的总反应方程式为4NH3+2NO+2O2=6H2O+3N2 |
|||
答案 |
D | |||
| 题号 | 12 |
|
||
出处 |
2021海淀期末 | |||
| 题干 | 聚合硫酸铁(PFS)是一种性能优异的无机高分子絮凝剂,其化学式通常表示为[Fe2(OH) 2a(SO4)3-a]b。某化工厂制备PFS并用其处理废水。 I.用硫酸铜废液制备PFS 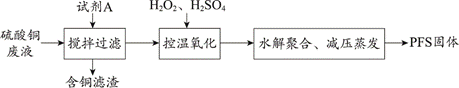 (1)试剂A为___。 (2)“控温氧化”发生反应的离子方程式为__。 (3)测定PFS样品中的n(OH-):取ag样品,溶解于V1mLc1 mol∙L−1HCl溶液中,用KF溶液掩蔽Fe3+(使Fe3+不能与OH-反应),滴入酚酞溶液,再用c2 mol∙L−1NaOH溶液滴定,到达滴定终点时消耗NaOH溶液体积为V2mL。agPFS样品中的n(OH-)=__mol。 II.用石灰乳-PFS法处理含砷废水 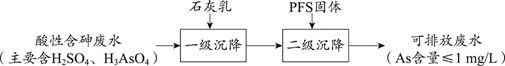 已知: i.常温下,Ca3(AsO4)2、CaHAsO4的Ksp均大于FeAsO4的Ksp,Fe2(HAsO4)3可溶; ii.常温下,溶液中含砷微粒的物质的量分数与pH的关系如图。 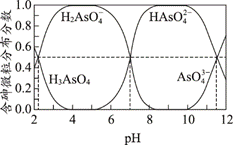 (4)下列说法不正确的是___(填序号)。 a.NaH2AsO4溶液的pH<7 b.pH=11.5时,c(H2AsO4-)+ 2c(HAsO42-)+ 3c(AsO43-)+c(OH-)=c(H+) c.Na3AsO4溶液中, 3c(Na+)=c(AsO43-)+c(HAsO42-)+c(H2AsO4-)+c(H3AsO4) (5)“一级沉降”中,石灰乳的作用是___。 (6)“二级沉降”中,溶液的pH在8~10之间,PFS形成的Fe(OH)3胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为___。 |
|||
答案 |
(1) Fe (2) 2Fe2++H2O2+2H+=2Fe3++2H2O (3)(c1V1-c2V2)×10-3 (4) bc (5)中和酸性溶液,调节溶液pH;形成CaSO4、Ca3(AsO4)2沉淀,去除部分SO42-和H3AsO4 (6) Fe(OH)3+HAsO42-=FeAsO4-+2OH-+H2O |
|||
| 题号 | 13 |
|
||||||||||||||||||
出处 |
2021海淀期末 | |||||||||||||||||||
| 题干 | 实验小组探究酸对Fe3++3SCN- Fe(SCN)3平衡的影响。将0.005 mol∙L−1FeCl3溶液(接近无色)和0.01 mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。 Fe(SCN)3平衡的影响。将0.005 mol∙L−1FeCl3溶液(接近无色)和0.01 mol∙L−1KSCN溶液等体积混合,得到红色溶液。取两等份红色溶液,进行如下操作并记录现象。(1)FeCl3水解显酸性的原因是___(用方程式表示)。 (2)甲同学认为加入酸后,会使Fe3++3SCN-  Fe(SCN)3体系中___浓度改变,导致该平衡正向移动,溶液颜色加深。 Fe(SCN)3体系中___浓度改变,导致该平衡正向移动,溶液颜色加深。【设计并实施实验】 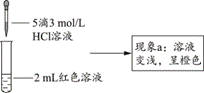 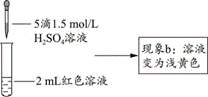 【查阅资料】 Fe3+和Cl-、SO42-均能发生络合反应: Fe3++4Cl-  [FeCl4]-(黄色);Fe3++2SO42- [FeCl4]-(黄色);Fe3++2SO42- [Fe(SO4)2]-(无色)。 [Fe(SO4)2]-(无色)。实验I.探究现象a中溶液颜色变化的原因
(4)根据实验①和实验②的结果,从平衡移动角度解释现象a:___。 实验Ⅱ.探究现象b中溶液呈浅黄色的原因
(6)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(5)中的一种,请将实验④的操作及现象补充完整:___、___。 |
|||||||||||||||||||
答案 |
(1) Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+(2) c(Fe3+) (3)排除稀释使溶液颜色变化的干扰(证明溶液颜色变化是否与稀释有关) (4)在Fe3++3SCN-  Fe(SCN)3平衡体系中加入盐酸,Fe3+和Cl-发生络合反应使得c(Fe3+)减小,平衡逆向移动,c[Fe(SCN)3]减小,使溶液颜色变浅呈橙色 Fe(SCN)3平衡体系中加入盐酸,Fe3+和Cl-发生络合反应使得c(Fe3+)减小,平衡逆向移动,c[Fe(SCN)3]减小,使溶液颜色变浅呈橙色(5) FeCl4-和Fe(SCN)3 (6)加入1mL蒸馏水,再加入5滴1.5 mol∙L−1H2SO4溶液;得无色溶液 |
|||||||||||||||||||
| v福建省实践教学工作室 蔡实践 设计制作 v |