 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 武汉市2021届高中毕业生三月质量检测 | |
|---|---|
| 本卷共有试题:19 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 化学源自生活和生产实践,并随着人类社会的进步而不断发展。下列关于化学史的描述错误的是 A.拉瓦锡提出了燃烧的氧化学说 B.侯氏制碱法中制得的是烧碱 C.门捷列夫发现了元素周期律 D.阿伏加德罗提出了分子学说 |
|||
答案 |
B | |||
| 题号 | 2 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 水是维持生命过程的必须物质。下列说法正确的是 A.水是一种弱电解质 B.酸雨是指pH<7.0的降水 C. 50℃时的pH=6.6的纯净水显酸性 D.冰雪融化时吸收热量且破坏化学键 |
|||
答案 |
A | |||
| 题号 | 3 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 《本草纲目》有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列有关说法正确的是 A.“烧薪柴”发生了氧化还原反应 B. “薪柴之灰”的成分是碳酸钾 C.“以灰淋汁”的操作是萃取和分液 D. “取碱浣衣”与肥皂洗衣原理相同 |
|||
答案 |
A | |||
| 题号 | 4 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 下列化学用语的表示正确的是 A. O2和O3互为同位素 B.甲基的电子式为由 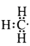 C.基态Fe2+价电子排布式为3d5 D.基态碳原子价电子轨道表示式为 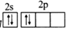 |
|||
答案 |
B |
|||
| 题号 | 5 |
|
|||||||||||||||
出处 |
2013山东高考 | ||||||||||||||||
| 题干 | 利用实验器材(规格和数量不限),能完成相应实验的一项是
|
||||||||||||||||
答案 |
D | ||||||||||||||||
| 题号 | 6 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 下列离子方程式书写正确的是 A.用醋酸除去水垢:CaCO3+2H+=Ca2++CO2↑+H2O B.硫化亚铁与浓硫酸混合加热:FeS+2H+  Fe2++H2S↑ Fe2++H2S↑C.向浓碳酸钠溶液中滴加少量稀盐酸:CO32-+H+=HCO3- D.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 CO32-=Al2(CO3)3↓ |
|||
答案 |
C | |||
| 题号 | 7 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 设NA为阿伏加德罗常数的值。下列有关叙述正确的是 A. 10.4g苯乙烯分子中含π键的数目为0.4NA B. 0.1mol KHSO4晶体中含有HSO4-的数目为0.1NA C. 0.1mol P4(黄磷)含有的孤电子对数目为0.6NA D. 5.6 g Fe与足量稀硝酸反应转移的电子数目为0.2NA |
|||
答案 |
B | |||
| 题号 | 8 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 《天工开物》记载:“凡火药以硝石、硫磺为主,草木灰为辅·····而后火药成声”,涉及的主要反应为:S+2KNO3+3C K2S+N2↑+3CO2↑。下列说法正确的是 K2S+N2↑+3CO2↑。下列说法正确的是A.电负性:N>O>S B.单质硫属于共价晶体 C.第一电离能:N>O>C D.KNO3中的共价键只含有σ键 |
|||
答案 |
C | |||
| 题号 | 9 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 某激光染料是一种烃的含氧衍生物,分子球棍模型如图所示。下列叙述错误的是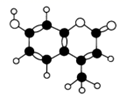 A.分子中碳原子杂化方式只有两种 B.能使酸性KMnO4溶液褪色 C. 1mol该物质最多能与3mol Br2反应 D. 1mol该物质最多能与含2molNaOH的溶液反应 |
|||
答案 |
D | |||
| 题号 | 10 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 已知:MnO2+2NaBr+2H2SO4 MnSO4+Na2SO4+Br2↑+2H2O,实验室利用如下图所示的装置制备溴苯。下列说法正确的是 MnSO4+Na2SO4+Br2↑+2H2O,实验室利用如下图所示的装置制备溴苯。下列说法正确的是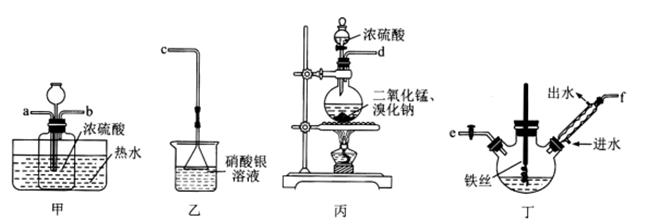 A.装置接口按气流方向连接顺序为:d→b→a→e→f→c B.装置甲中进行水浴加热的目的是防止溴蒸气冷凝 C.装置乙中有淡黄色沉淀产生,可证明苯与溴发生了取代反应 D.可用乙醇作洗涤剂除去溴苯中溶解的少量Br2 |
|||
答案 |
B | |||
| 题号 | 11 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 我国科技工作者设计以CoP和Ni2P纳米片为催化电极材料,电催化合成偶氮化合物的新装置,如图所示(R代表烃基)。下列说法错误的是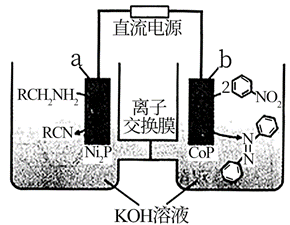 A.硝基苯分子中所有原子可能共面 B.该离子交换膜是阴离子交换膜 C.电极a的电极电势低于电极b D.阳极反应为RCH2NH2-4e-+4OH-=RCN +4H2O |
|||
答案 |
C | |||
| 题号 | 12 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 下列有关物质结构和性质的比较中,错误的是 A.分解温度:CaCO3 C.稳定性:金刚石>石墨 D.沸点:对羟基苯甲醛>邻羟基苯甲醛 |
|||
答案 |
C | |||
| 题号 | 13 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 工业上常用还原沉淀法处理含铬废水(含Cr2O72-和CrO42-),其流程如下图所示: 下列说法错误的是 A.若将含铬废水加少量水稀释,溶液中 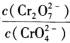 的值增大 的值增大B.当反应速率 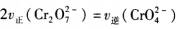 时,则反应①达到平衡 时,则反应①达到平衡C.步骤②中,若还原1molCr2O72-离子,消耗6mol FeSO4 D.常温下Ksp[Cr(OH)3]≈1x10-32,调节溶液的pH略大于5可使Cr3+沉淀完全 |
|||
答案 |
A | |||
| 题号 | 14 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 室温时,向100 mL0.lmol/L NH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线见图。下列说法正确的是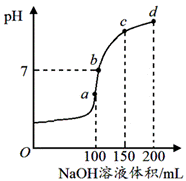 A. a点:c(NH4+)+c(H+)=c(Na+)+c(OH-) B. c点:c(SO42-)>c(NH3•H2O)>c(NH4+) C. d点:c(SO42-)>c(NH4+)>c(OH-) D. a、b、c、d四个点,b点水的电离程度最大 |
|||
答案 |
A | |||
| 题号 | 15 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | “一锅法”用[Ru]催化硝基苯(PhNO2,Ph-表示苯基)与醇(RCH2OH)反应为仲胺(RCH2NHPh),反应过程如下图所示。下列叙述错误的是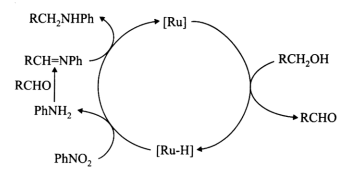 A.反应原料中的RCH2OH不能用RCH(CH3)OH代替 B.历程中存在反应PhNH2+RCHO→RCH=NPh+H2O C.有机物还原反应的氢都来自于RCH2OH D.该反应过程结束后RCHO没有剩余 |
|||
答案 |
D | |||
| 题号 | 16 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 肼(N2H4)的熔点2.0℃、沸点113.5℃,极易溶于水,在碱性介质中具有还原性。在强碱性介质中,用次氯酸钠氧化尿素[CO(NH2)2]可得粗肼,再经蒸馏得到肼溶液。回答下列问题: I.制备NaClO强碱性溶液 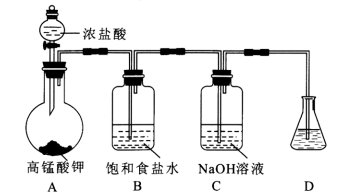 (1)在加入实验药品之前必须进行的操作是_______。 (2)A为氯气发生装置,A中反应的化学方程式是_______。 (3)次氯酸钠高于35℃容易分解。制备NaClO强碱性溶液时需要注意的两个关键问题是_______。 II.制备N2H4 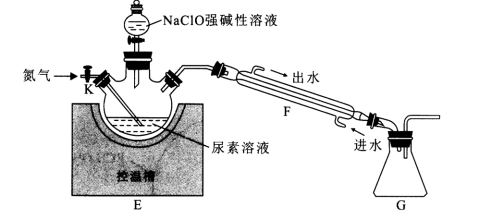 (4)仪器F的名称是_______。 (5)通入N2目的是_______。 (6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为_______.。 (7)向三颈烧瓶中加入NaClO强碱性溶液应当_______. (填“一次大量”或“分批少量”)加入,充分反应后制得粗肼。蒸馏提纯时应调节控温槽的温度略高于_______℃,得到肼溶液。 |
|||
答案 |
(1)检查装置气密性 (2)2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2+8H2O (3)冷水浴;滴加速率适中 (4)冷凝管 (5)排除装置内的O2,防止生成的N2H4被氧化 (6)  (7)分批少量;113.5℃ |
|||
| 题号 | 17 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 化合物F是用于治疗慢性阻塞性肺病的中间体,其合成路线如下: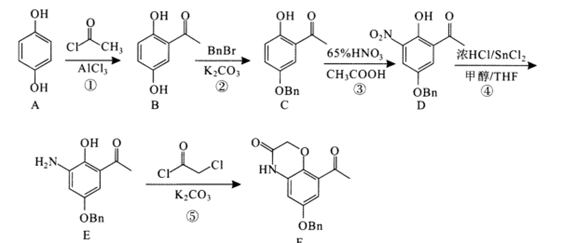 已知:BnBr代表 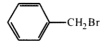 回答下列问题: (1)A的名称为_______。 (2)E中含氮官能团的名称为_______。 (3)反应⑤中K2CO3的作用是_______。 (4)B有多种同分异构体,写出两种满足下列条件的同分异构体的结构简式_______、_______。 a.既能发生水解反应,也能与FeCl3溶液发生显色反应 b.核磁共振氢谱有4组峰,峰面积之比为3:2:2:1 (5)双酚A(  )与 )与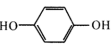 _______(填“是”或“不是”)同系物。 _______(填“是”或“不是”)同系物。(6)工业上合成聚碳酸酯的路线为:  写出生成双酚A的化学方程式:_______,由双酚A制备聚碳酸酯的反应类型是_______。 |
|||
答案 |
(1)对苯二酚 (2)氨基 (3)催化剂 (4) 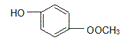 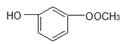 (5)不是 (6) 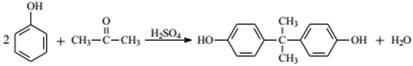 ;缩聚反应 ;缩聚反应 |
|||
| 题号 | 18 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | 甲醇是重要的化工原料,可用于制备甲醛、醋酸等产品。利用CH4与O2在催化剂的作用下合成甲醇。 主反应: 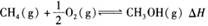 副反应:CH4(g)+2O2(g)⇌CO2(g)+2H2O(g) 回答下列问题: (1)已知:CH3OH(l)=CH3OH(g) ΔH=+138 kJ/mol,CH4和CH3OH的燃烧热分别为-890 kJ/mol、-726 kJ/mol,则主反应的ΔH=_______kJ/mol。 (2)科技工作者结合实验与计算机模拟结果,研究了CH4、O2和H2O(g)(H2O的作用是活化催化剂)按照一定体积比在催化剂表面合成甲醇的反应,部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。 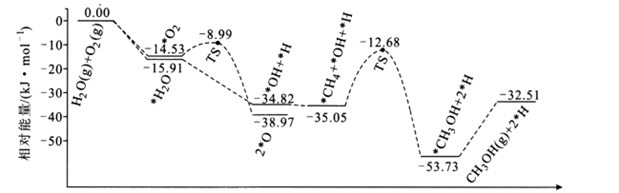 ①在催化剂表面上更容易被吸附的是_______(填“H2O”或“O2”)。 ②该历程中正反应最大的活化能为_____kJ/mol,写出该步骤的化学方程式____。 (3)在恒温的刚性密闭容器中,分别按照CH4、O2的体积比为2:1以及CH4、O2、H2O(g)的体积比为2:1:8反应相同的时间,所得产物的选择性(如甲醇的选择性= 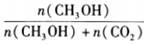 )如下图所示: )如下图所示: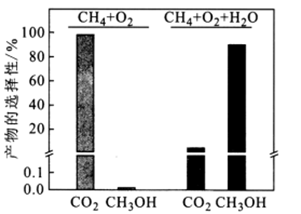 ①向反应体系中加入H2O(g)能够显著提高甲醇选择性的原因:_______。 ②向上述刚性密闭容器中按照体积比2:1:8充入CH4、O2和H2O(g),在450K下达平衡时,CH4的转化率为50%,CH3OH的选择性为90%,则副反应的压强平衡常数Kp=_______(计算结果保留1位小数)。 |
|||
答案 |
(1) -26 (2)①H2O②22.37; 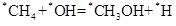 (3)①加入水蒸气,促进副反应逆向进行,二氧化碳减少;催化剂更容易吸附水,可提高甲醇选择性 ②54.9 |
|||
| 题号 | 19 |
|
||
出处 |
2021武汉3月 | |||
| 题干 | CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是CuFeS2,还含有少量SiO2)制备CuCl的工艺流程如下: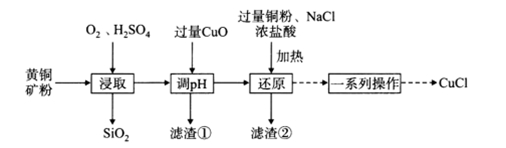 回答下列问题: (1)CuCl是一种难溶于水和乙醇的白色固体,但其易溶于氨水的原因是_______。 (2)“浸取”时,硫元素转化为硫酸根离子,则反应的离子方程式为_______。 (3)“滤渣①”的成分是_______(填化学式)。 (4)已知在水溶液中存在平衡:CuCl+2Cl-⇌[CuCl3]2-(无色)。“还原”的离子方程式为_______,当出现_______现象时,表明“还原”进行完全。 (5)“一系列操作”是_______、过滤、用无水乙醇洗涤、真空干燥。 (6)CuCl形成的一种立方晶胞如图所示。已知晶胞参数a=0.542nm,该晶体的密度为________g/cm(写出计算式,设阿伏加德罗常数的值为NA)。 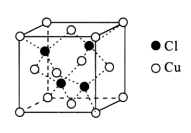 |
|||
答案 |
(1)氯化亚铜中Cu+可以与NH3形成配合物 (2) 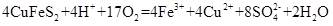 (3)CuO和Fe(OH)3 (4) 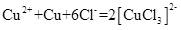 ;溶液由蓝色变为无色 ;溶液由蓝色变为无色(5)向溶液中加入大量水 (6) 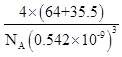 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |