 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 武汉市2021届高中毕业生四月质量检测 | |
|---|---|
| 本卷共有试题:19 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 《易经》描述的“泽中有火”“上火下泽”,其中燃烧的气体主要是 A.氢气 B.一氧化碳 C.甲烷 D.乙烯 |
|||
答案 |
C | |||
| 题号 | 2 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | “嫦娥五号”带回了富含氦-3的月壤,氦-3可作为未来可控核聚变(3He+3He→4He+21H)的清洁能源。下列说法正确的是 A.氦-3聚变属于化学变化 B.3He和4He具有相同的性质 C.He位于第1周期第IIA族 D.2H和3He具有相同的中子数 |
|||
答案 |
D | |||
| 题号 | 3 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 化学实验常对“纸”进行湿润。下列说法正确的是 A.用湿润的pH试纸测定氯化铵溶液的pH B.用湿润的淀粉碘化钾试纸检验氯气 C.用湿润的红色石蕊试纸检验浓盐酸的挥发性 D.将滤纸湿润后置于漏斗中组装成过滤器 |
|||
答案 |
B | |||
| 题号 | 4 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 下表中陈述I和陈述II均正确,且具有因果关系的是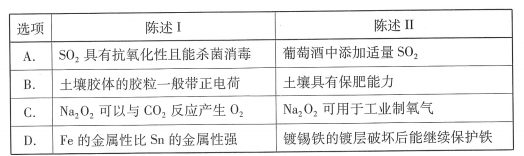 |
|||
答案 |
A | |||
| 题号 | 5 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 下列有关海水资源的开发利用方法中错误的是 A.在太阳能资源相对充足的沿海地区建造海水淡化厂 B.利用“海水→溴→溴化氢→溴”的流程生产溴 C.利用“海水→氢氧化镁→氯化镁→金属镁”的流程生产镁 D.利用“海水→氯化钠→金属钠→氢氧化钠”的流程生产烧碱 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 一定条件下,有反应:Fe+6HCN+2K2CO3=K4[Fe(CN)6]+H2↑+2CO2↑+2H2O.下列说法正确的是 A.H2O与HCN分子间可形成氢键 B.HCN分子的电子式为 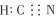 C.K2CO3中CO32-的空间构型为三角锥形 D.K4[Fe(CN)6]的中心离子的核外价层电子排布式为3d5 |
|||
答案 |
A | |||
| 题号 | 7 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 用NA表示阿伏加德罗常数的值。下列说法正确的是 A.1 mol NaHSO4晶体中阴阳离子总数目为2NA B.1 mol SiO2中含有Si-0极性共价键的数目为2NA C.78g苯与足量H2发生加成反应时破坏π键数目为3NA D.16gCH4与足量氯气在光照下反应生成CH3C1分子数目为NA |
|||
答案 |
A | |||
| 题号 | 8 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 中药提取物阿魏酸对艾滋病病毒有抑制作用。下列关于阿魏酸的说法错误的是 A.其分子式为C10H10O4 B.该分子中所有碳原子可能共平面 C.能与FeCl3溶液发生显色反应 D.1 mol阿魏酸最多与5mol H2发生加成反应  |
|||
答案 |
D | |||
| 题号 | 9 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 我国学者首次发现非水相氮还原过程中的多米诺效应。如下图所示,一旦完成反应①,反应②③将自发完成。下列叙述错误的是 A.整个过程中反应①活化能最高 B.反应②断裂氮氮三键形成离子键 C.微粒半径:r(N3-)>r(N)>r(Li)>r(Li+) D.该还原过程难以在水溶液中实现  |
|||
答案 |
C | |||
| 题号 | 10 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 化合物甲(H3BNH3)可由无机苯(分子式为B3N3H6,结构式为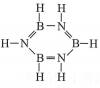 )通过反应制得:3CH4+2B3N3H6+6H2O=-3CO2+6H3BNH3.下列叙述错误的是 )通过反应制得:3CH4+2B3N3H6+6H2O=-3CO2+6H3BNH3.下列叙述错误的是A.化合物甲中存在配位键 B.无机苯的二氯代物有3种 C.第一电离能大小为:N>O>C>B D.该反应属于氧化还原反应 |
|||
答案 |
B | |||
| 题号 | 11 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 近期,我国科学家合成了一种催化剂,实现了如图所示的异丁烷氧化脱氢。下列说法错误的是 A.图中C4H8的名称为2-甲基丙烯 B.上述物质中碳原子的杂化方式有3种 C.反应中涉及极性键和非极性键的断裂与生成 D.该反应为C4H10+CO2→C4H8+CO+H2O  |
|||
答案 |
C | |||
| 题号 | 12 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 中科院研制出了双碳双离子电池,以石墨(C,)和中间相炭微粒球(MCMB)为电极,电解质溶液为含有KPF.的有机溶液,其充电示意图如下。下列说法错误的是 A.固态KPF.为离子晶体 B.放电时,K+向左迁移 C.放电时,负极反应为Cn+xPF6-=xe-=Cn(PF6)x D.充电时,若阴极增重39g则阳极增重145g 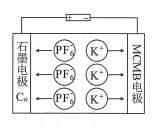 |
|||
答案 |
C | |||
| 题号 | 13 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 粉煤灰含有50.19%的Al2O3、37.29%的SiO2,其余为Fe2O3、CaO等。粉煤灰“一步酸溶法”生产氧化铝的工艺流程如下图所示,该法制得的氧化铝纯度优于国家冶金级一级品标准。下列叙述错误的是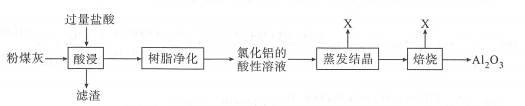 A.“滤渣”的主要成分是二氧化硅 B.“树脂净化”的目的是将Al3+与Fe3+、Ca2+分离 C.“蒸发结晶”前应向氯化铝溶液中加入盐酸 D.循环使用X既降低成本,又防止污染环境 |
|||
答案 |
C | |||
| 题号 | 14 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 我国科学家使用某种电解液提高了水系锌锰电池的性能。该电解液阴离子结构如图所示,其中W、X、Y、Z为原子半径依次增大的短周期元素,且最外层电子数之和为23.下列说法正确的是 A.元素的非金属性:X>Z>Y>W B.该离子中X都满足8电子稳定结构 C.最高价氧化物水化物的酸性Y强于Z D.W单质不能通过置换反应生成X单质 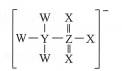 |
|||
答案 |
B | |||
| 题号 | 15 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 在25℃时,向2.0 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1mol/L的NaHSO4溶液,滴加时溶液中含碳微粒物质的量(n mmol)与溶液pH的关系如图所示(CO2因逸出未画出)。下列选项错误的是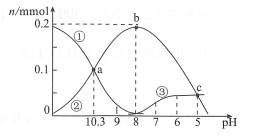 A.HCO3-的水解平衡常数Kb=1.0x10-9 B.a点对应溶液中c(SO42-)=c(CO32-) C.曲线②表示HCO3-的物质的量变化情况 D.Na2CO3溶液中c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
|||
答案 |
B | |||
| 题号 | 16 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 化合物G是有机合成的重要中间产物,其合成路线如下: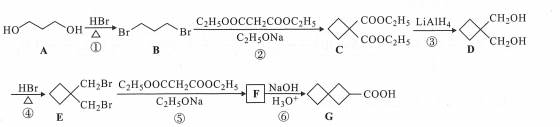 回答下列问题: (1)A的名称为 。 (2)B中所含官能团的名称为 。 (3)反应③的反应类型为 。 (4)反应④的化学方程式为 。 (5)F的结构简式为 。 (6)D有多种同分异构体,写出满足下列条件的所有同分异构体(不考虑立体异构) 的结构简式 。 a.分子中含有六元环; b.不能与金属钠反应; c.核磁共振氢谱有三组峰,且峰面积之比为3:2:1. (7)根据题设信息设计以1,5-二溴戊烷和C2H5OOCCH2COOC2H5为原料合成 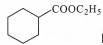 的路线 (其他试剂任选)。 的路线 (其他试剂任选)。 |
|||
答案 |
(1)1,3-丙二醇 (2)溴原子(或碳溴键) (3)还原反应 (4)  (5) 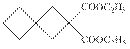 (6) 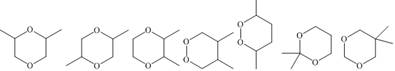 (7) 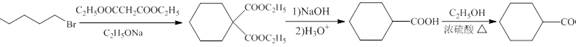 |
|||
| 题号 | 17 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 据古籍记载,焙烧绿矾(FeSO4·7H2O)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。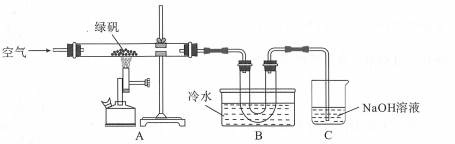 回答下列问题: (1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,无明显现象。再向试管中加入适量 (填写试剂名称),振荡,溶液变为红色。由此可知该样品 (填 “已”或“未”)变质。 (2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式 。 (3)装置B中冷水的作用是 。 (4)为防止倒吸,停止实验时应进行的操作是 。 (5)用KMnO4滴定法测定绿矾的纯度。称取2.850g绿矾样品,配制成250mL溶液,量取25.00mL待测液于锥形瓶中,用0.0100 mol/L KMnO4酸性溶液滴定,反应消耗KMnO4酸性溶液体积的平均值为20.00mL. ①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、 。 ②该实验滴定终点时溶液的颜色变为 。 ③该绿矾样品中FeSO4·7H2O的质量分数为 (计算结果保留3位有效数字)。 |
|||
答案 |
(1)氯水(或双氧水);未 (2)4FeSO4·7H2O+O22Fe2O3+4SO3+28H2O (3)将SO3和水蒸气冷凝,有利于SO3被水吸收生成H2SO4 (4)熄灭酒精喷灯,继续通入空气至冷却到室温 (5)①250 mL容量瓶、胶头滴管 ②粉(浅)红色③0.975(或97.5%) |
|||
| 题号 | 18 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | 锌是冶金、化工、纺织等行业应用广泛的重要金属之一。一种以含锌烟尘(主要成分是ZnO,还含有少量Si、Cu、Cd、Pb、Sb等元素的氧化物)制备金属锌的工艺流程如下: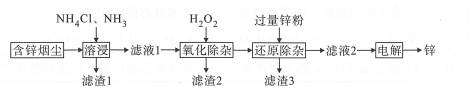 已知:“滤液1”含有的离子有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+和SbCl52-. 回答下列问题: (1)基态锌原子的价层电子轨道表示式(电子排布图)为 。 (2)“溶浸”中主要的化学方程式为 。 (3)“滤渣1”的主要成分是PbO、 。 (4)“滤渣2”是Sb2O5,“氧化除杂”的离子方程式为 。 (5)“还原除杂”中加过量锌粉的目的是 。 (6)工业上一般利用闪锌矿(主要成分是ZnS)为原料制备锌,ZnS的晶胞结构如右图,则锌的配位数为_;已知晶胞参数为acm,该晶体的密度为 g/cm3(写出计算式,设阿伏加德罗常数的值为NA). 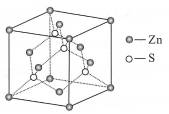 |
|||
答案 |
(1) (2)ZnO+2NH4Cl +2NH3===[Zn(NH3)4]Cl2+H2O (3)SiO2 (4)2SbCl52-+ 2H2O2 +H2O===Sb2O5↓+10Cl-+6H+ 或2SbC l52-+ 2H2O2 +6NH3·H2O===Sb2O5↓+10Cl-+6NH4++5H2O (5)与杂质[Cu(NH3)4 ]2+、[Cd(NH3)4 ]2+发生反应,将杂质全部除去 (6)4; 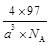 |
|||
| 题号 | 19 |
|
||
出处 |
2021武汉4月 | |||
| 题干 | CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。 主反应:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH1 副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.0 kJ/mol 回答下列问题: (1)已知CH4、CO和H2的燃烧热ΔH分别为-890.3 kJ/mol、-283.0 kJ/mol和-285.8 kJ/mol,该催化重整主反应的ΔH1= kJ/mol.有利于提高CO2平衡转化率的条件是 (填标号)。 A.高温高压B.高温低压C.低温高压D.低温低压 (2)在刚性密闭容器中,进料比 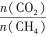 分别等于1.0、1.5、2.0,且反应达到平衡状态。 分别等于1.0、1.5、2.0,且反应达到平衡状态。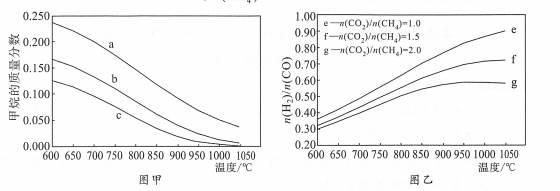 ①甲烷的质量分数随温度变化的关系如图甲所示,曲线c对应的 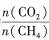 = . = .②反应体系中, 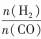 随温度变化的关系如图乙所示,随着进料比 随温度变化的关系如图乙所示,随着进料比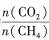 的增加, 的增加, 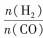 的值 (填“增大”、“不变”或“减小”),其原因是 。 的值 (填“增大”、“不变”或“减小”),其原因是 。(3)在800℃、101 kPa时,按投料比 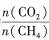 =1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的压强平衡常数Kp=_ (计算结果保留3位有效数字)。 =1.0加入刚性密闭容器中,达平衡时甲烷的转化率为90%,二氧化碳的转化率为95%,则副反应的压强平衡常数Kp=_ (计算结果保留3位有效数字)。(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气CO和H2,同时获得甘油醛。则催化电极a为 极,催化电极b产生CO的电极反应式为 .  |
|||
答案 |
(1)+247.3;B (2)①2.0 ②减小;随着投料比n(CO2)/n(CH4)的增加,n(CO2)增大,副反应平衡正向移动,导致n(CO)增多,n(H2)减少,n(H2)/n(CO)减小。 (3)1.06 (4)阳;CO2+H2O+2e−===CO+2OH- (2分,或“2CO2+2e−===CO32-+CO”) |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |