 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2021年广州市普通高中毕业班综合测试(一) | |
|---|---|
| 本卷共有试题:21 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 关于下列诗句或谚语隐含的化学知识,说法错误的是 A.“爆竹声中一岁除”,爆竹中的火药含有硫黄 B.“木棉花落絮飞初”,“絮”的主要成分是纤维素 C.“谷雨种甘蔗”,甘蔗中的蔗糖是多糖 D.“雷雨发庄稼”,该过程有硝酸生成 |
|||
答案 |
C | |||
| 题号 | 2 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 2020年我国北斗三号全球卫星导航系统正式开通,其中“铷(Rb)原子钟”被誉为卫星的“心脏”,下列有关说法错误的是 A.铷元素位于IA族 B.铷的金属性比钠弱 C.8537Rb的中子数为48 D.8537Rb和8737Rb具有相同的电子数 |
|||
答案 |
B | |||
| 题号 | 3 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | “打造青山常在,绿水长流、空气常新的美丽中国”。下列水处理方法错误的是 A.用臭氧进行自来水消毒 B.用硫酸铁除去水中的悬浮物 C.用Na2SO4除去硬水中的Mg2+和Ca2+ D.用Na2S除去工业废水中的Cu2+和Hg2+ |
|||
答案 |
C | |||
| 题号 | 4 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 下列应用不涉及氧化还原反应的是 A.小苏打用作食品膨松剂 B.工业合成氨实现人工固氮 C.烟气脱硫(SO2)生产硫酸 D.利用铝热反应焊接钢轨[] |
|||
答案 |
A | |||
| 题号 | 5 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 锂碘电池可用于心脏起搏器,电池反应可简化为:2Li+I2=2LiI。电池工作时,下列说法正确的是 A.碘电极是电池的负极 B.锂电极发生还原反应 C.电池正极反应:Li-e-=Li+ D.电流从碘电极经外电路流向锂电极 |
|||
答案 |
D | |||
| 题号 | 6 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 维生素C又称“抗坏血酸”,广泛存在于水果蔬菜中,结构简式如下图所示。下列关于维生素C的说法错误的是 A.分子式为C6H8O6 B.能与金属钠反应 C.能发生酯化反应 D.不能使酸性高锰酸钾溶液褪色 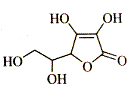 |
|||
答案 |
D | |||
| 题号 | 7 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 利用下列装置进行实验,不能达到实验目的的是 A.用①收集H2 B.用②蒸干AICl3溶液制备无水氯化铝 C.用③分离NaCl溶液和BaSO4固体 D.用④分离CCl4萃取碘水后的有机层和水层 |
|||
答案 |
B | |||
| 题号 | 8 |
|
|||||||||||||||
出处 |
2021广州综合1 | ||||||||||||||||
| 题干 | 根据下列实验操作和现象所得的结论正确的是
|
||||||||||||||||
答案 |
A | ||||||||||||||||
| 题号 | 9 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 对于0.1 mol·L-1Na2CO3溶液,下列说法正确的是 A.升高温度,溶液中c(OH-)增大 B.稀释溶液,溶液中c(H+)减少 C.加入NaOH固体,溶液pH减小 D.C(Na+)+c(H+)=C(HCO3-)+c(CO32-)+c(OH-) |
|||
答案 |
A | |||
| 题号 | 10 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 以[PdCl4]2-作催化剂合成H2O2,反应过程如图所示。下列叙述错误的是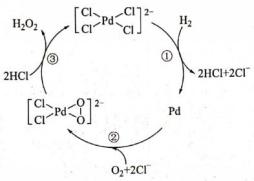 A.总反应是 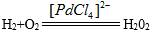 B.该过程中Pd的化合价有0、+2和+4 C.Pd、[PdCl2O2]2-都是反应中间体 D.反应③中Pd的成键数目保持不变 |
|||
答案 |
B | |||
| 题号 | 11 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 下列叙述Ⅰ和Ⅱ均正确且有因果关系的是 |
|||
答案 |
A | |||
| 题号 | 12 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 设NA为阿伏加德罗常数的值,下列说法正确的是 A.标准状况下,224LN2中含有7NA个质子 B.常温常压下,18gH2O含有3NA个原子 C.1L0.1 mol·L-1NH4CI溶液中含有0.1NA个NH4+ D.1 mol Mg与足量稀H2SO4反应,转移NA个电子 |
|||
答案 |
B | |||
| 题号 | 13 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z:化合物XW3与WZ相遇会产生白烟。下列叙述正确的是 A.单质的沸点:W>X B.元素X的含氧酸均为强酸 C.化合物YW中含有离子键 D.简单离子半径:Z>Y>X |
|||
答案 |
C | |||
| 题号 | 14 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 探究是培养创新精神和实践能力的手段。用如下装置探究氯气的性质,图中三支试管口均放置浸有NaOH溶液的棉花。下列对实验现象的分析错误的是 A.①中淀粉KI试纸变蓝,说明氯气的氧化性强于碘 B.②中产生白色沉淀,说明氯气与水反应生成Cl— C.③中的溶液变为棕黄色,说明氯气有氧化性 D.④溶液先变红后褪色,说明氯水有酸性和漂白性  |
|||
答案 |
C | |||
| 题号 | 15 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 我国科学家合成了一种新型的Fe-SnO2催化剂,用该催化剂修饰电极,可实现在室温条件下电催化氮气制备铵盐和硝酸盐。下列说法错误的是 A.电解过程中H+由b极区向a极区迁移 B.阴极反应式为N2+6e—+8H+=2NH4 + C.电解一段时间,阳极区的pH减小 D.电解一段时间,阴极、阳极消耗N2的物质的量之比为3:5 |
|||
答案 |
D | |||
| 题号 | 16 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 25℃时,c(H 2C2O4)+c(HC2O4—)+c(C2O42—)=0.1 mol·L-1的草酸溶液中,lgc(H 2C2O4)、lgc(HC2O4—)和lgc(C2O42—)随pH变化的关系如下图所示。下列说法错误的是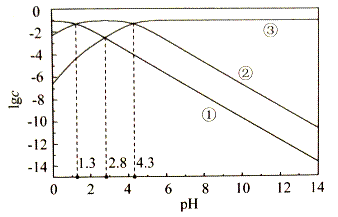 A.曲线①代表lgc(H 2C2O4),曲线③代表lgc(C2O42—) B.lg[Ka2(H 2C2O4)]=-4.3 C.PH=2.8时,C(HC2O4—)>0.01 mol·L-1 D.pH由0变化至14过程中,  先增大后不变 先增大后不变 |
|||
答案 |
D | |||
| 题号 | 17 |
|
||||||||||||
出处 |
2021广州综合1 | |||||||||||||
| 题干 | 高纯超细氧化铝是一种新型无机功能材料,以硫酸铵和硫酸铝为原料制备复盐硫酸铝铵 [NH4Al(SO4)2·12H2O],经硫酸铝铵热分解可制得高纯超细氧化铝,其流程如下:  回答下列问题: (1)操作①需加入稀H2SO4,其目的是 。 (2)“纯化”的方法为 。 (3)实验室用如下装置利用热分解法制备高纯超细氧化铝粉并对其分解气成分进行探究:  反应一段时间后,取三份NaOH吸收液于三支试管中分别进行如下实验,填写下表:
(4)为了测定高纯超细氧化铝粉中Al2O3的质量分数,可用EDTA(简写为H4Y)标准溶液滴定。取m g氧化铝粉溶于盐酸,加入过量的V1mL c1 mol·L-1EDTA标准溶液,充分反应后,再用c2mol·L-1的Zn2+标准溶液滴定过量的EDTA至终点,消耗Zn2+标准溶液体积为V2mL。反应的离子方程式:Al3++Y4-=AlY-、zn2++Y4-=ZnY22-。 Al2O3的质量分数为 。 |
|||||||||||||
答案 |
(1)抑制Al3+、NH4+的水解 (2)重结晶 (3)①NH3 ②含有SO3 ③滴加几滴高锰酸钾溶液;溶液不褪色 2NH4Al(SO4)2 12H2O 2 NH3 +4SO3 +Al2O3+25H2O (4)(c1V1-c2V2)·0.051/m |
|||||||||||||
| 题号 | 18 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | SCR催化剂是工业上广泛应用的燃煤烟气脱硝催化剂,其主要成分为TiO2、V2O5,以及少量SiO2、CaO、Al2O3、Fe2O3等。一种从废SCR催化剂中回收钨的工艺如下: 回答下列问题 (1)“酸浸还原”中V2O5。转化成可溶于水的VOC2O4,VOC2O4中V的化合价是 , 该反应的化学方程式为 。可用浓盐酸代替草酸,但缺点是 。 (2)“碱浸”时WO3转化为WO42-的离子方程式为 。 (3)“试剂a”可选用 (选填“盐酸”、“氢氧化钠”或“氨水”)。“滤渣”的主要成分是 。 (4)常温下Ksp[Ca(OH)2]=5.5×10-6,Ksp(CaWO4)=8.7×10-9。“沉钨”过程中不断加入石灰乳,当测得“滤液”中pH=13时,c(WO42-)为 mol·L-l(保留2位有效数字) (5)“熔融电解”过程中阴极反应为WO42-+6e-=W+4O2-。电解过程中石墨阳极有损耗并有气体产生,用反应方程式解释该现象 。 |
|||
答案 |
(1)+4;V2O5+3H2C2O4=2VOC2O4+2CO2↑+3H2O;产生氯气,污染空气 (2)WO3+2OH-=WO42-+H2O (3)盐酸;Al(OH)3,H2SiO3 (4)1.6×10-5 (5)2CaWO4+3C  3CO2↑+2W+2CaO 3CO2↑+2W+2CaO |
|||
| 题号 | 19 |
|
|||||||||||||||||||||
出处 |
2021广州综合1 | ||||||||||||||||||||||
| 题干 | 羰基硫(COS)是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。以FeOOH作催化剂,分别以CO和CO2为碳源,与H2S反应均能产生COS,反应如下 反应I:CO(g)+H2S(g)⇌COS(g)+H2(g) 反应Ⅱ:CO2(g)+H2S(g)⇌COS(g)+H2O(g) (1)以CO为碳源制COS反应分两步进行,其反应过程能量变化如图所示。 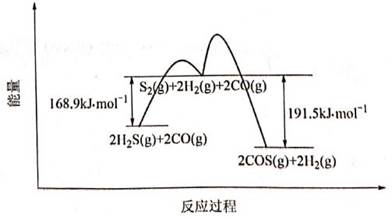 ①CO(g)+H2S(g)  COS(g)+H2(g) △= 。 COS(g)+H2(g) △= 。②决定COS生成速率的步骤是 (填“第1步”或“第2步”) (2)在密闭容器中按下表投料,分别发生反应Ⅰ和反应Ⅱ(N2不参与反应),反应时间和压强相同时,测得COS的物质的量分数随温度变化关系如下图实线所示(虚线表示平衡曲线)。
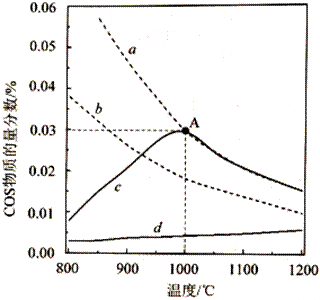 ①已知相同条件下,反应Ⅰ速率比反应Ⅱ快。反应Ⅰ的平衡曲线是 (填标号)。800~ 1200℃时,曲线d中COS物质的量分数不断增大,原因是 。 ②下列说法正确的是 (填标号)。 A.降低反应温度,CO和CO2的平衡转化率均增大 B.该实验中, 900℃时,反应Ⅰ的COS生成速率大于分解速率 C.恒温恒容下反应Ⅱ达到平衡后,增大N2的体积分数,平衡正向移动 D.选用合适的催化剂均能增大反应Ⅰ和反应Ⅱ的COS的平衡产率 ③A点对应的平衡体系中,H2S的转化率为 ,该温度下反应的平衡常数K= (写计算式) (3)用COS处理过的粮食食用前需水洗,水洗时COS转化为两种气体,该反应的化学方程式为 。 |
||||||||||||||||||||||
答案 |
(1)①-11.3kJ/mol ②第1步 (2)①a;温度升高,反应速率加快,相同时间内生成的COS物质的量增多,物质的量分数不断增大 ②AB ③3%, 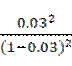 (3)COS+H2O=CO2+H2S |
||||||||||||||||||||||
| 题号 | 20 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | H5O2Ge(BH4)3是钙钛矿型化合物(ABX3型),量子化学计算结果显示,其具有良好的光电化学性能。 回答下列问题: (1)基态Ge的价层电子排布式为 。 (2)H5O2+的结构如下图所示。H5O2+含有共价键的类型是 。1mol H5O2+含有化学键的个数为 。  (3)根据杂化轨道理论,BH4-由B的4个 (填杂化轨道类型)杂化轨道与4个H的1s轨道重叠而成,因此BH4-的空间构型是 。 (4) CsPbI3是H5O2Ge(BH4)3的量子化学计算模型,CsPbI3的晶体结构如下图所示 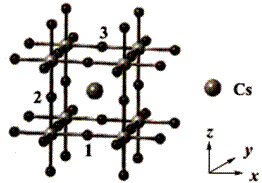 ①原子1的坐标为(  ,0,0),则原子2和3的坐标分别为 、 。 ,0,0),则原子2和3的坐标分别为 、 。②I-位于该晶体晶胞的 (填“棱心”、“体心”或“顶角”)。 ③已知H5O2Ge(BH4)3晶体属于立方晶系,晶胞参数为anm,阿伏加德罗常数的值为NA,则H5O2Ge(BH4)3的密度为 g·cm-3(列出计算式)。 |
|||
答案 |
(1)4s24p2 (2)极性键;4NA (3)SP3;正四面体 (4)①(0,0,1/2)、(1/2,1,1);②棱心;③ 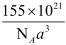 |
|||
| 题号 | 21 |
|
||
出处 |
2021广州综合1 | |||
| 题干 | 化合物G是防晒剂的有效成分,其合成路线如下: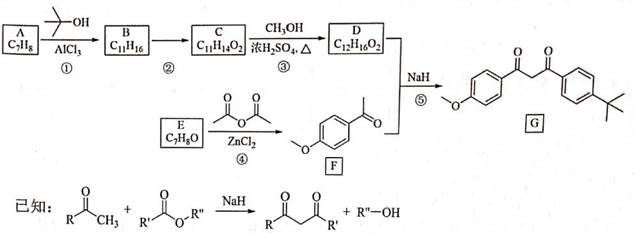 回答下列问题: (1)A的化学名称为 。G中所含官能团的名称为 。 (2)反应①的反应类型为 。 (3)D是酯类物质,反应②所需试剂是 。 (4)反应④的化学方程式为 。 (5)芳香化合物X是F的同分异构体,X的结构只含一个环,核磁共振氢谱有四组峰,峰面积之比为6:2:1:1。X可能的结构有 种,写出两种可与FeCl3溶液发生显色反应的X的结构简式 。 (6)写出以 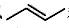 和 和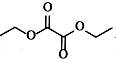 为原料制备化合物 为原料制备化合物 的合成路线。(其它无机试剂任选) 的合成路线。(其它无机试剂任选) |
|||
答案 |
(1)甲苯;醚键、羰基 (2)取代反应 (3)酸性高锰酸钾溶液 (4) 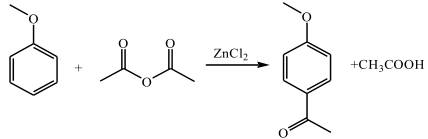 (5)6; 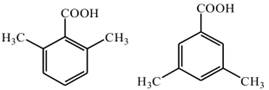 (6) 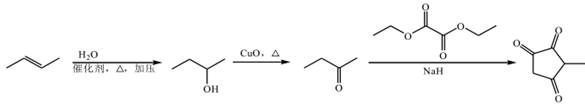 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |