 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 福建省2017届普通高中毕业班质量检查 | |
|---|---|
| 本卷共有试题:12 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
2017福建质检 | |||
| 题干 | “千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,只留清白在人间。”明代诗人于谦的《石灰吟》中对“CaCO3→CaO”的转化进行拟人化描述。下列说法正确的是 A.上述转化属于分解反应 B.上述转化过程放出大量热 C.生成的CaO可作氯气的干燥剂 D. CaCO3是水泥的主要成分之一 |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 设NA为阿伏加德罗常数的值。下列说法正确的是 A. 1L0.1mol/LNaC1O溶液中,C1O-的数目为0.1NA B.常温常压下,11.2LCH4含有的共用电子对数目为2NA C. 16gO2与O3混合气体中,氧原子的数目为1.5NA D. 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
|||
答案 |
D | |||
| 题号 | 3 |
|
||
出处 |
2017福建质检 | |||
| 题干 | “分子马达”的关键组件三蝶烯的结构如右图所示。下列说法正确的是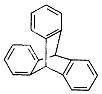 A.三蝶烯是苯的同系物 B.三蝶烯能发生取代反应 C.三蝶烯的一氯代物有6种 D.三蝶烯分子中所有原子可能在同一平面上 |
|||
答案 |
B | |||
| 题号 | 4 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 下列措施中,能使饱和食盐水中c(OH-)减小的是 A.加热 B.投入金属钠 C.加入NaHSO4固体 D.以惰性电极电解 |
|||
答案 |
C | |||
| 题号 | 5 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 下列实验能达到实验目的的是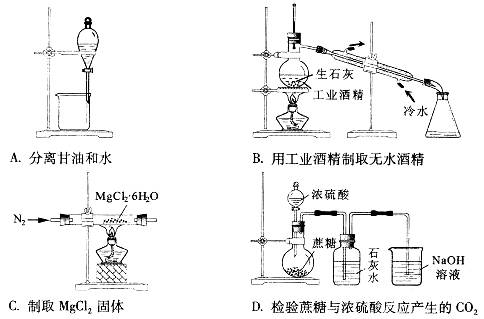 |
|||
答案 |
B | |||
| 题号 | 6 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 二甲醚(CH3OCH3)--空气燃料电池的工作原理如右图所示。电池工作时,下列说法正确的是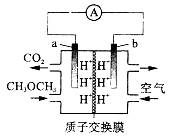 A. a极区溶液的pH变大 B. b极有H2O生成 C. a极反应式:CH3OCH3+3O2--12e-=2CO2↑+6H+ D.每消耗11.2LO2(标准状况),有2molH+向左侧移动 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||
出处 |
2017福建质检 | |||
| 题干 | X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如右下图所示反应关系吸图中“—”相连的两种物质能发生反应)。下列判断一定正确的是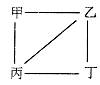 A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族 C.4种原子中,Y原子半径最大 D.W的最高化合价为+7 |
|||
答案 |
C | |||
| 题号 | 8 |
|
||
出处 |
2017福建质检 | |||
| 题干 | NaNO2可用作食品添加剂。NaNO2能发生以下反应: 3NO2-+2H+=NO3-+2NO↑+H2O NO2-+Ag+=AgNO2↓(淡黄色) 某化学兴趣小组进行以下探究。回答有关问题: (l)制取NaNO2 反应原理:Na2CO3+2NO2=NaNO2+NaNO3+CO2 Na2CO3+NO+ NO2=2NaNO2+CO2 用下图所示装置进行实验。 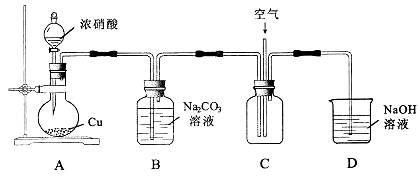 ①铜与浓硝酸反应的化学方程式为___________。 ②实验过程中,需控制B中溶液的pH>7,否则产率会下降,理由是________。 ③往C中通入空气的目的是_______________(用化学方程式表示)。 ④反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。 (2)测定粗产品中NaNO2的含量 称取mg粗产品,溶解后稀释至250mL。取出25.00 mL溶液,用cmol/LKMnO4酸性溶液平行滴定三次,平均消耗的体积为VmL。 已知:2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O ①稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______(填标号)。 A.容量瓶 B.量筒 C.胶头滴管 D.锥形瓶 ②当观察到_______时,滴定达到终点。 ③粗产品中NaNO2的质量分数为________(用代数式表示)。 (3)设计实验方案证明母液中含有NO2-_____________(限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液)。 |
|||
答案 |
(1)①Cu+4HNO3=Cu(NO3)2+2NO2+2H2O ②如果pH<7,亚硝酸盐会转化为硝酸盐和NO气体 ③2NO+O2=2NO2;④过滤 (2)①A、C;②溶液出现粉红色,且半分钟内不褪色 ③  (3)取样。加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有NO2- |
|||
| 题号 | 9 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 氯化钴(CoCl2)可溶于水,常用作湿度和水分的指示剂,工业上也可用于制取钴。 (1)钴元素的常见化合价与铁元素相同。往CoCl2溶液中加入NaOH溶液产生粉红色沉淀,露置于空气中一段时间后,沉淀变为棕褐色。 ①化合态钴的常见化合价有_______。 ②沉淀由粉红色变为棕褐色反应的化学方程式为_______________。 (2)将CoCl2溶于浓盐酸中能形成[CoCl4]2-,溶液中存在平衡: [Co(H2O)6]2++4Cl-  [CoCl2]2-+6H2O [CoCl2]2-+6H2OT 1℃时,将0.025mol CoCl2·6H2O溶于50mL 12mol/L浓盐酸中,再加水稀释至100 mL。溶液中c(Cl-)与温度(T)的关系如右图所示。 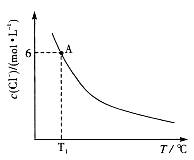 ① Tl ℃时,取10mL上述溶液稀释至l00mL,稀释后的溶液中c(Cl-)______0.6mol·L-1(填“>”“=”或“<”)。 ②由图可知,上述反应的△H______0(填“>”“=”或“<”)。 ③根据A点数据,计算出T 1℃时上述反应的平衡常数为________。 (3)采用右下图所示装置(Ti-Ru电极为惰性电极)电解CoCl2溶液制取钴。Co能与强酸反应产生H2,不利于Co的沉积,故电解过程中,CoCl2溶液的pH通常控制在3.9~4.2。 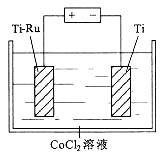 ① Co沉积在_______(填“Ti-Ru”或“Ti”)电极上。 ②CoCl2溶液中常含有少量Cu2+、Fe3+、Na+等,为提高产品的纯度和电流效率,电解前必须将其中的_______(填离子符号)除去。 ③若用CoSO4溶液代替CoCl2溶液,会使产率降低。其原因是_____________。 |
|||
答案 |
(1)①+2、+3;②4Co(OH)2+2H2O+O2=4Co(OH)3 (2)①> ②> ③7.72×10-4(mol/L)-4 (3)①Ti ②Cu2+、Fe3+ ③OH-在阳极放电,使溶液的pH降低 |
|||
| 题号 | 10 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 将铜锌合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示: 回答下列问题: (1)H2O2的电子式为_________;“溶解”后铜元素的主要存在形式是______(填离子符号)。 (2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______________。 (3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应: S2O32-+2H+=S↓+SO2↑+H2O ①该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。 25℃时,溶液中各种离子浓度由大到小的顺序为_________。 [已知: 25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5] ②若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多 3.2g,则v(Na2S2O3)=_____mol/(L·s)(忽略溶液体积变化的影响)。 (4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_____________。 (5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥_______________。 [已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15] (6)下列情况可能造成测得的铜含量偏高的是______(填标号)。 A.铜锌合金中含少量铁 B. “沉淀”时,I2与I-结合生成I3-:I2+I-=I3- C. “转化”后的溶液在空气中放置太久,没有及时滴定 D. “滴定”过程中,往锥形瓶内加入少量蒸馏水 |
|||
答案 |
(1) ;Cu2+ ;Cu2+(2)2H2O2(l)=O2↑+4H+ (3)①c(CH3COO-)、c(NH4+)、c(H+)、c(OH-)②0.050 (4)2Cu2++4I-=2CuI+I2;(5)4.0×10-3;(6)A、C |
|||
| 题号 | 11 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 铍及其化合物的应用正日益被重视。 (l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为__________。 (2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。 A.都属于p区主族元素 B.电负性都比镁大 C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7 (3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(155lK)比铝的熔点(930K)高,原因是______________。 (4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。 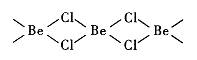 ① a属于__________(填“极性”或“非极性”)分子。 ② b中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。 ③ c中Be原子的杂化方式为__________。 ④氯化铍晶体中存在的作用力有_(填标号)。 A.范德华力 B. σ键 C.极性键 D.非极性键 E.离子键 (5)BeO立方晶胞如下图所示。 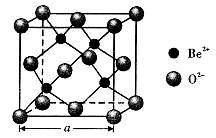 ① BeO晶体中,O2-的配位数为___________。 ②若BeO晶体的密度为dg/cm3,则晶胞参数a =______nm(列出计算式即可)。 |
|||
答案 |
(1) ;(2)B、D;(3)Be原子半径比Al原子半径小,金属性更强; ;(2)B、D;(3)Be原子半径比Al原子半径小,金属性更强;(4)①非极性;②  ;③sp3;④A、B、C; ;③sp3;④A、B、C;(5)①4;② 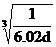 |
|||
| 题号 | 12 |
|
||
出处 |
2017福建质检 | |||
| 题干 | 苯并环己酮是合成萘(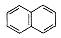 )或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如下图所示: )或萘的取代物的中间体。由苯并环己酮合成1-乙基萘的一种路线如下图所示: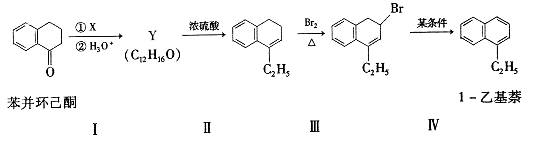 己知: 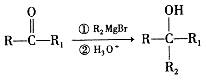 回答下列问题: (l)萘的分子式为_______;苯并环己酮所含官能团是_______(填名称)。 (2)Y的结构简式为_________。 (3)步骤Ⅲ的反应属于_________(填反应类型)。 (4)步骤Ⅳ反应的化学方程式为____________(标明反应条件)。 (5)苯并环己酮用强氧化剂氧化可生成邻苯二甲酸。邻苯二甲酸和乙二醇经缩聚反应生成的高分子化合物的结构简式是________。 (6)1-乙基萘的同分异构体中,属于萘的取代物的有_______种(不含1-乙基萘)。W也是1-乙基萘的同分异构体,它是含一种官能团的苯的取代物,核磁共振氢谱显示W有三种不同化学环境的氢原子,且个数比为1:1:2,W的结构简式为_________。 (7)仍以苯并环己酮为原料,上述合成路线中,只要改变其中一个步骤的反应条件和试剂,便可合成萘。完成该步骤:__________(表示方法示例:A  B)。 B)。 |
|||
答案 |
36.(15分,除标注外,其余每小题2分) (1)C10H8、羰基(或酮羰基);(2) 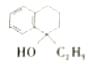 ;(3)取代反应; ;(3)取代反应;(4) 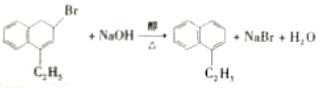 (5) 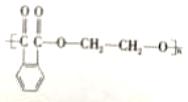 或 或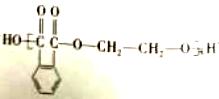 ; ;(6)11;  ; ;(7) 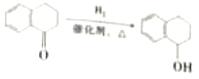 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |