 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 湖北四地七校考试联盟2017届高三2月联考 | |
|---|---|
| 本卷共有试题:12 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 化学与生活密切相关,下列说法错误的是 A.食盐中加有碘,用其配成的溶液遇淀粉变蓝 B.厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 C.使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害 D.硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂 |
|||
答案 |
A | |||
| 题号 | 2 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 下列化学方程式或离子方程式正确的是 A.苏打溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-= CaCO3↓+H2O B.少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3- C.双氧水作脱氯剂,用于消除水中的氯气:Cl2+H2O2=2HCl+O2 D.FeI2溶液中通入一定量的氯气:2Fe2++2I-+ 2Cl2 = 2Fe3++I2+ 4Cl- |
|||
答案 |
C | |||
| 题号 | 3 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 短周期元素a、b、c、d原子序数依次增大。a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族;下列说法错误的是 A.a、b、d均可以与c形成两种或多种二元化合物 B.d的原子半径是这些元素中最大的 C.a与d形成的化合物可以抑制水的电离 D.常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
|||
答案 |
D | |||
| 题号 | 4 |
|
|||||||||||||||
出处 |
湖北四地联考 | ||||||||||||||||
| 题干 | 为实现实验目的,选用的装置、实验操作均正确的是
|
||||||||||||||||
答案 |
A | ||||||||||||||||
| 题号 | 5 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 某芳香族化合物的分子式为C7H6Cl2,则该有机物可能的结构有几种 A.9 B.10 C.11 D.12 |
|||
答案 |
B | |||
| 题号 | 6 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 汽车尾气中的NO2已造成严重空气污染,适当的反应条件下,通过下列反应可以将NO2变成无害的N2:NO2 + G 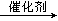 N2 + H2O + nX(未配平的反应式)。式中n是系数。下列化合物中可以作为满足上述要求的化合物G的是? N2 + H2O + nX(未配平的反应式)。式中n是系数。下列化合物中可以作为满足上述要求的化合物G的是?A.NH3 B.CO2 C.SO2 D.C2H5OH |
|||
答案 |
D | |||
| 题号 | 7 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 常温下,CdS的Ksp=1.6×10-29;H2S电离常数K1=1.2×10-7,K2=7.0×10-15,根据以上信息,下列说法正确的是 A.常温下NaHS溶液中,HS—水解常数小于其电离常数 B.常温下Na2S溶液中,S2—第一步水解常数为  C.CdS(s)+2H+(aq)  Cd2+(aq)+H2S(aq)的平衡常数为 Cd2+(aq)+H2S(aq)的平衡常数为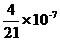 D.常温下CdS的溶解度为5.76×10-13g |
|||
答案 |
C | |||
| 题号 | 8 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下几个方案: 方案I 取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度 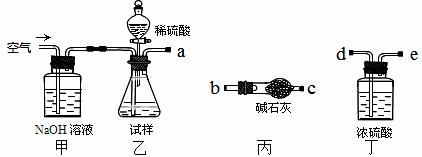 (1)乙中发生反应的方程式为 。 (2)仪器接口的连接顺序为(装置可以重复使用)a ,丁的作用是 。 (3)当样品充分反应完后,缓慢通入空气的目的是: 。 方案Ⅱ ①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g。 (4)下列仪器中,该方案不会用到的是 。 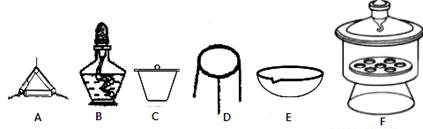 (5)判断样品完全分解的方法是 ;本实验至少需要称量 次。 (6)有同学认为方案Ⅱ高温煅烧的过程中会发生MgCO3 + SiO2  MgSiO3 + CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗? ,(填“正确”或“错误”)请说明自己的理由: 。 MgSiO3 + CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗? ,(填“正确”或“错误”)请说明自己的理由: 。 |
|||
答案 |
(1)4MgCO3·Mg(OH)2·5H2O+ 5H2SO4= 5MgSO4+11 H2O + 4CO2↑ (2)debcb(c) 除去CO2中的水蒸气 (3)将装置中残留的CO2全部赶出被完全吸收 (4)E (5)样品连续两次高温煅烧,冷却称量质量相差0.1g以内 4 (6)错误该反应的发生不影响生成CO2和水蒸气的量 |
|||
| 题号 | 9 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。 (1)已知:CH4、CO、H2的燃烧热分别为890 kJ•mol-1、283 kJ•mol-1、285.8 kJ•mol-1,计算下列反应的反应热。CO2(g)+CH4(g)=2CO(g)+ 2H2(g)ΔH= kJ•mol-1。 (2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2  CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。 CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。①该反应的ΔH 0(填“>”或“<”) ②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是 。 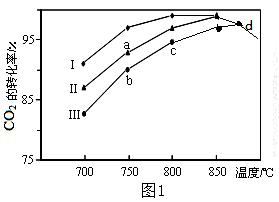 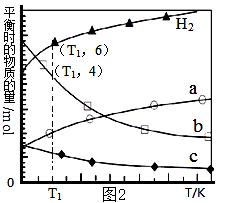 (3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示: C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:①该反应在 自发进行(填“低温”或“高温”)。 ②b代表的物质是 。 ③T1温度下的平衡转化率为 ,相对于起始状态,平衡时气体的平均分子量增大的百分率为 (保留三位有效数字)。 |
|||
答案 |
(1)+247.6 (2)①<②d均达到平衡状态,催化剂不影响平衡转化率 (3)①低温 ②H2O ③50% 23.1% |
|||
| 题号 | 10 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。 (1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为 。 (2)可采用电解法将上述吸收液中的NO2—转化为无毒物质,同时再生Ce4+,其原理如右图所示。 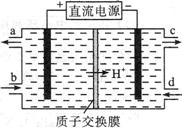 ①Ce4+从电解槽的 (填字母序号)口流出。 ②写出阴极的电极反应式 。每消耗1mol NO2-,阴极区H+物质的量减少 mol。 (3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下: 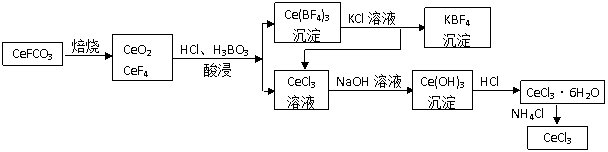 ①焙烧过程中发生的主要反应方程式为 。 ②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是 。 ③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq)  3KBF4(s) + CeCl3 (aq)平衡常数为 。 3KBF4(s) + CeCl3 (aq)平衡常数为 。④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是 。 |
|||
答案 |
(1)2:1 (2)①a ②2NO2 - +8H++6e—=N2↑+4H2O 1 (3)①4CeFCO3+ O2  3 CeO2+ CeF4+4CO2 不释放氯气,减少对环境的污染 3 CeO2+ CeF4+4CO2 不释放氯气,减少对环境的污染② 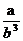 ③NH4Cl固体分解产生的HCl可以抑制CeCl3的水解。 |
|||
| 题号 | 11 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 物质的组成与结构决定了物质的性质与变化,回答下列问题: (1)量子力学把电子在原子核外的一个空间运动状态称为一个 ,电子除空间运动状态外,还有一种运动状态叫做 。 (2)硒常用作光敏材料,基态硒原子的价电子排布式为 ;与硒同周期的p区元素中第一电离能大于硒的元素有 种。 (3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为 ,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式 。SnCl4分子的空间构型为  (4)某晶体的晶胞结构如上图所示,该晶体的化学式为 ,该晶胞参数为:a= 250.4 pm, c = 666.1 pm,γ = 120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为 ,计算上述晶体中A和B两原子间的最小核间距为 。(保留四位有效数字) (5)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为 的一个原子。 |
|||
答案 |
(1)原子轨道 自旋 (2)4s24p4 3 (3)sp3杂化 2As2S3+2 SnCl2+4HCl = As4S4 + 2 SnCl4+2H2S↑ 正四面体形 (4)AB (1/3,2/3,1/2) 144.6pm (5)0.732r或( 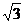 -1)r -1)r |
|||
| 题号 | 12 |
|
||
出处 |
湖北四地联考 | |||
| 题干 | 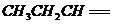 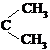 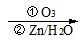  上述反应可用来推断烯烃的结构,某单烯烃A可以发生如下图示的转化,回答下列问题 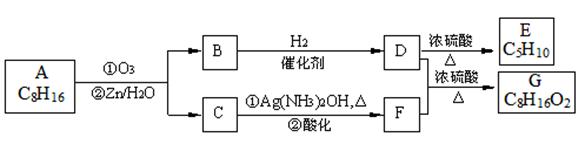 (1)B的分子式为 ,D中含有官能团的名称 。 (2)C-F中步骤①的方程式 ,该反应的反应类型是 (3)B无银镜反应,D在浓硫酸存在下加热可得到能使溴水褪色且只有一种结构的物质E(不考虑立体异构),则A的结构简式为 (4)G的同分异构体中,满足下列要求的结构有 种(不考虑立体异构) ①属于酯类;②酸性条件下水解能得到相对分子质量为74的有机物 (5)已知: 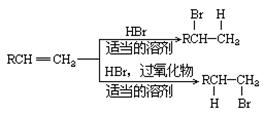 请写出由C制备2-丙醇的合成路线 |
|||
答案 |
(1)C5H10O 羟基 (2)CH3CH2CHO + 2Ag(NH3)2OH  CH3CH2COONH4+3NH3+2Ag↓+H2O CH3CH2COONH4+3NH3+2Ag↓+H2O氧化反应 (3)(CH3CH2)2C=CHCH2CH3 (4)16 (5) 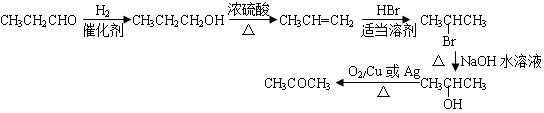 |
|||
| v福建省实践教学工作室 蔡实践 设计制作 v |