 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出
登录 注册
注册 首页
首页 题库检索
题库检索 我的试卷夹
我的试卷夹 编辑板
编辑板 试卷库
试卷库 个人菜单
个人菜单 化学社区
化学社区 实践课堂
实践课堂 退出
退出 |
| 我的试卷夹 | 编辑板 | 试题检索 | 新建试卷 | 个人菜单 | 组卷帮助 |
|---|
| 2017年高考北京理综卷化学试题 | |
|---|---|
| 本卷共有试题:11 | 【下载本试卷】【下载试卷答案】 【整份卷另存在我的试卷夹】【 整份卷放入试卷编辑板】 |
| 题号 | 1 |
|
||||||||
出处 |
2017北京高考 | |||||||||
| 题干 | 古丝绸之路贸易中的下列商品,主要成分属于无机物的是
|
|||||||||
答案 |
A | |||||||||
| 题号 | 2 |
|
||
出处 |
2017北京高考 | |||
| 题干 | 2016年IUPAC命名117号元素为Ts(中文名“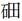 ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是 ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是A.Ts是第七周期第ⅦA族元素 B.Ts的同位素原子具有相同的电子数 C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts核素符号是  |
|||
答案 |
D | |||
| 题号 | 3 |
|
||
出处 |
2017北京高考 | |||
| 题干 | 下列变化中,气体被还原的是 A.二氧化碳使Na2O2固体变白 B.氯气使KBr溶液变黄 C.乙烯使Br2的四氯化碳溶液褪色 D.氨气使AlCl3溶液产生白色沉淀 |
|||
答案 |
B | |||
| 题号 | 4 |
|
||
出处 |
2017北京高考 | |||
| 题干 | 我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下: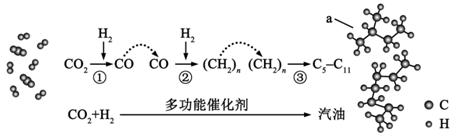 下列说法不正确的是 A.反应①的产物中含有水 B.反应②中只有碳碳键形成 C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2-甲基丁烷 |
|||
答案 |
B | |||
| 题号 | 5 |
|
||||||||||||||||||||
出处 |
2017北京高考 | |||||||||||||||||||||
| 题干 | 根据SO2通入不同溶液中实验现象,所得结论不正确的是
|
|||||||||||||||||||||
答案 |
C | |||||||||||||||||||||
| 题号 | 6 |
|
||
出处 |
2017北京高考 | |||
| 题干 | 聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下: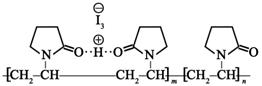 (图中虚线表示氢键) (图中虚线表示氢键)下列说法不正确的是 A.聚维酮的单体是  B.聚维酮分子由(m+n)个单体聚合而成 B.聚维酮分子由(m+n)个单体聚合而成C.聚维酮碘是一种水溶性物质 D.聚维酮在一定条件下能发生水解反应 |
|||
答案 |
B | |||
| 题号 | 7 |
|
||||||
出处 |
2017北京高考 | |||||||
| 题干 | 下述实验中均有红棕色气体产生,对比分析所的结论不正确的是
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应 C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
|||||||
答案 |
D | |||||||
| 题号 | 8 |
|
||
出处 |
2017北京高考 | |||
| 题干 | 羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示: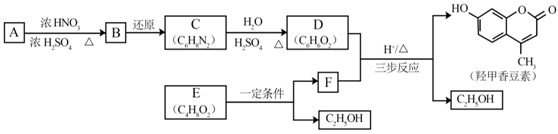 已知: 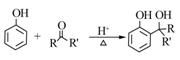 RCOOR|+R||OH  RCOOR||+ R|OH(R、R|、R||代表烃基) RCOOR||+ R|OH(R、R|、R||代表烃基)(1)A属于芳香烃,其结构简式是___________________。B中所含的官能团是_____________。 (2)C→D的反应类型是___________________。 (3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式: ______________________________。 (4)已知:2E 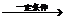 F+C2H5OH。F所含官能团有 F+C2H5OH。F所含官能团有 和___________。 和___________。(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式: 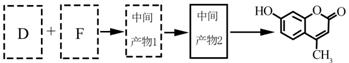 |
|||
答案 |
(1)  ,硝基; ,硝基;(2)取代; (3)2CH3CH2OH+O2  2CH3CHO+2H2O 2CH3CHO+O2 2CH3CHO+2H2O 2CH3CHO+O2  2CH3COOH 2CH3COOH CH3CH2OH+CH3COOH 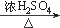 CH3COOCH2CH3+H2O; CH3COOCH2CH3+H2O;(4) 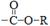 ;(5)D: ;(5)D: ,F:CH3CH2OOCCH2COCH3,中间产物1为: ,F:CH3CH2OOCCH2COCH3,中间产物1为: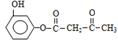 ,中间产物2: ,中间产物2: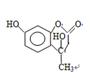 |
|||
| 题号 | 9 |
|
||||||||||||||||||||||||
出处 |
2017北京高考 | |||||||||||||||||||||||||
| 题干 | TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: 资料:TiCl4及所含杂质氯化物的性质
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1 ①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。 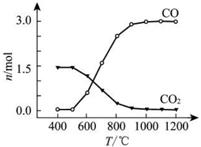 ②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。 ③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。 ④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤 渣中含有_____________。 (2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: 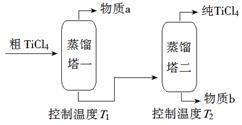 物质a是______________,T2应控制在_________。 |
|||||||||||||||||||||||||
答案 |
(1)①TiO2(g)+2Cl2(g)+ 2C(s)=TiCl4(g)+2CO(g) △H=-45.5kJ/mol ②>、 温度越高,CO的物质的量越多(或CO2的物质的量越少),说明CO2生成CO的反应是吸热反应,所以ΔH>0。③饱和食盐水、FeCl2溶液、NaOH溶液。④MgCl2、AlCl3、FeCl3(2)四氯化硅、 136℃~ 181℃ |
|||||||||||||||||||||||||
| 题号 | 10 |
|
||
出处 |
2017北京高考 | |||
| 题干 | SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。 (1)SCR(选择性催化还原)工作原理:  ①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。 ②反应器中NH3还原CO2的化学方程式:____________。 ③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。 ④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60mg·L−1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L−1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L−1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________。 (2)NSR(NOx储存还原)工作原理: NOx的储存和还原在不同时段交替进行,如图a所示。 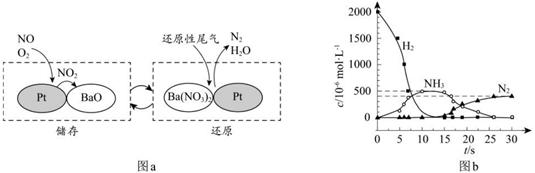 ①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原。储存NOx的物质是_________。 ②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。 ③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:_______  □15NNO+□H2O □15NNO+□H2O |
|||
答案 |
(1)①CO(NH2)2+H2O 2NH3↑+CO2↑ ②8NH3+6NO2 2NH3↑+CO2↑ ②8NH3+6NO2 7N2+12H2O 7N2+12H2O③2SO2+O2+4NH3+2H2O==2(NH4)2SO4 ④ 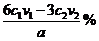 (2)①BaO ②8∶1 ③415NO+4NH3+3O2  415NNO+6H2O 415NNO+6H2O |
|||
| 题号 | 11 |
|
||||||||||||
出处 |
2017北京高考 | |||||||||||||
| 题干 | 某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。 向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。 (1)检验产物 ①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。 ②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。 (2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验: ①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
②对Fe3+产生的原因作出如下假设: 假设a:可能是铁粉表面有氧化层,能产生Fe3+; 假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+; 假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+; 假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。 ③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。 实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。 实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。  (3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。 |
|||||||||||||
答案 |
(1)①加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀。(或者加入足量稀盐酸(或稀硫酸),固体未完全溶解)。②Fe2+ (2)Fe+2Fe3+=3Fe2+ 。②4Fe2++O2+4H+=Fe3++2H2O、白色沉淀 ③0.05 mol·L-1 NaNO3溶液、FeCl2溶液(或FeSO4溶液)、按图连接好装置,电流表指针发生偏转,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深。 (3)溶液中存在反应:①Fe+2Ag+=Fe2++2Ag,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。 (3)由于存在过量铁粉,溶液中存在反应有①Fe+2Ag+=Fe2++2Ag,反应生成的Fe2+能够被Ag+氧化发生反应②Ag++Fe2+=Ag+Fe3+,生成的Fe3+与过量铁粉发生反应③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。 |
|||||||||||||
| v福建省实践教学工作室 蔡实践 设计制作 v |